| i |
健康影響評価全般 |
|
| |
Ⅱ-Q1. |
リスク評価はどのように行われるのですか。(平成15年8月) |
|
Ⅱ-A1. |
食品安全委員会は、食品の安全性について科学的データに基づき客観的かつ中立公正に評価を行います。
|
(1) |
その物質の一般的な毒性を調べる90日反復投与毒性試験や1年間反復投与毒性試験 |
|
|
(2) |
胎児に奇形が生じるかどうかを調べる催奇形性試験 |
|
|
(3) |
発がん性があるかどうかを調べる発がん性試験 |
|
|
(4) |
アレルギー性を調べる抗原性試験 |
|
|
(5) |
遺伝子を傷害するかどうか調べる変異原性試験 |
などの様々な試験の成績が厚生労働省に提出されます。 この委員会は、それらの試験成績等を踏まえ、その物質の安全性を科学的に評価します。評価の結果は、例えば、1日摂取許容量(ADI:Acceptable
Daily Intake)として示されます。ADIとは、人が生涯にわたり毎日摂取しても健康上の問題が生じない体重1kgあたりの量です。ADIは、以下のように定められます。
評価の対象物質に関する種々の動物試験の成績を評価し、各々の試験について何ら毒性影響が認められなかった量を求めます。各試験毎に求めた毒性が認められなかった量のうち、最も小さいものをその物質の無毒性量とします。人と動物の違い(種差)や個体差を勘案し、通常は、無毒性量の1/100の値をADIとして設定します。 |
|
|
| |
Ⅱ-Q4. |
リスク分析手法とはどのようなものですか。(平成15年9月) |
|
Ⅱ-A4. |
近年、食をめぐる状況の変化を背景に、食品の安全には「絶対」は無く、リスクの存在を前提にこれを評価し、制御する必要があることが国際的に認識されてきました。このような考えの下に世界各国でリスク分析手法の導入が進んでいます。「リスク分析手法」とは、食品を摂取することによる健康への悪影響の発生を防止、抑制するための手法のことで、次の3要素から成り立っています。
|
(1) |
食品に含まれる可能性のある危害要因が人の健康に及ぼす悪影響の程度を科学的に評価する「リスク評価」 |
|
|
(2) |
リスク評価の結果に基づき、食品の摂取による健康への悪影響の発生を防止、抑制するための措置を講ずる「リスク管理」 |
|
|
(3) |
リスク評価やリスク管理を実施するにあたり、関係者相互間で情報や意見を交換する「リスクコミュニケーション」 |
この手法の導入により、食品安全行政がこれまで以上に統一的、総合的に推進されることになります。 |
|
|
| |
Ⅱ-Q5. |
食品添加物や農薬などの安全性指標としての一日摂取許容量(ADI)は、以前、厚生労働省の薬事・食品衛生審議会で審議されていましたが、食品安全委員会が設立されてからは、どうなっているのですか。(平成15年10月) |
|
Ⅱ-A5. |
一日摂取許容量(ADI)の設定を含め、食品添加物や農薬などの安全性の評価は、リスク評価機関である食品安全委員会が実施します。食品安全委員会の評価結果に基づき、リスク管理機関である厚生労働省、農林水産省等が安全性を確保するために必要な措置を適切に講じていくことになります。 |
|
|
| |
Ⅱ-Q8. |
食品健康影響評価の中で物理的要因とは具体的にどのような要因があるのでしょうか。(平成15年11月) |
|
Ⅱ-A8. |
1. |
食品健康影響評価は、人の健康に悪影響を及ぼすおそれがある生物学的、化学的若しくは物理的な要因であって食品に含まれるおそれがあるもの、又は人の健康に悪影響を及ぼすおそれがある生物学的、化学的若しくは物理的な状態であって、食品が置かれるおそれがあるものが当該食品の摂取を通じて人の健康に及ぼす影響を評価することです。
食品健康影響評価は、科学的知見に基づき、客観的かつ中立公正に行われます。 |
|
2. |
食品に影響を及ぼすおそれがある物理的な要因については、幅広く想定されますが、具体例としては、異物や放射線が挙げられます。 |
|
|
|
| |
Ⅱ-Q22. |
食品安全委員会の食品健康影響評価(リスク評価)の審議状況を知りたいのですが、食品安全委員会のホームページのどこを見ればよいのですか。(平成16年8月) |
|
Ⅱ-A22. |
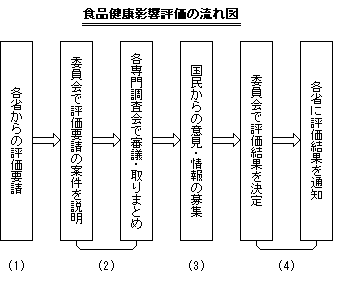
厚生労働省や農林水産省等のリスク管理機関から食品健康影響評価(リスク評価)に関する意見を要請された案件については、通常、以下に示す流れで審議が行われます。(食品健康影響評価の流れ図参照)
(1) |
各省から食品安全委員会にリスク評価が要請されます。 |
|
(2) |
食品安全委員会では、まず委員会会合で評価要請の趣旨について説明を受けた後、専門調査会に付託し、審議が行われます。 |
|
(3) |
その審議結果(案)について、原則として広く国民から4週間にわたって意見・情報の募集を行います。 |
|
(4) |
寄せられた意見・情報を踏まえ、専門調査会から報告があり、最終的に食品安全委員会において審議の上、評価結果を決定し、各省に通知することとなります。 |
なお、(3)の意見・情報の募集に先立ち、専門調査会での審議結果(案)について委員会会合において審議が行われています。 |
|
|
 |
|
|
以上の審議状況については当委員会のホームページでも知ることができます。
|
|
|
| |
Ⅱ-Q23. |
FAO/WHO合同食品添加物専門家会議「
FAO/WHO Joint Expert Committee on Food Additives (JECFA)」における添加物の安全性評価について教えてください。(平成16年8月) |
|
Ⅱ-A23. |
FAO/WHO合同食品添加物専門家会議「
FAO/WHO Joint Expert Committee on Food Additives (JECFA)」は、国連の食糧農業機関(FAO)と世界保健機関(WHO)が合同で運営する専門家会合として、1956年に設立され、毎年会合を開き、添加物、汚染物質及び動物用医薬品の安全性を科学的な観点から評価して、一日摂取許容量(ADI)、成分規格等を定めています。委員は、毒性学、分析化学等の専門家により構成されており、日本からも当委員会の専門委員も含め専門家がJECFAに参加しています。
JECFAによる安全性評価の結果は、日本を始め各国において添加物の指定・基準設定等の際の参考資料として用いられています。 |
|
|
| |
Ⅱ-Q30. |
科学的知見に基づいた評価について分かりやすく教えて下さい。また「定性的評価」、「定量的評価」についても教えてください。(平成16年12月) |
|
Ⅱ-A30. |
食品安全委員会では、科学的知見に基づいて中立・公正な立場で食品健康影響評価(リスク評価)を行っております。
具体的には、食品の摂取を通じ危害要因が人の健康にどのような影響をどの程度及ぼすかについて、国内外の研究の成果や動物試験の結果などの様々な科学的知見を基に、専門的知見を有する研究者等により構成される専門調査会、委員会で審議を行った上で、リスク評価の結果を出しています。
また、人の健康に影響を及ぼす危害要因についてリスクを評価するにあたって、定性的リスク評価とは、危害要因が食品の摂取を通じてどのような影響(有害性)を及ぼすかを評価することです。
さらに、定量的リスク評価とは、定性的リスク評価に量的概念を導入するもので、どのぐらいの量を摂取するとどの位の確率でどの程度の健康への影響があるかを評価することです。
|
|
|
| |
Ⅱ-Q32. |
食品安全委員会の行う食品健康影響評価の対象について教えてください。医薬品も対象となるのですか。(平成17年2月) |
|
Ⅱ-A32. |
食品安全委員会が行う食品健康影響評価は、すべての飲食物を対象としておりますが、薬事法で規定されている医薬品及び医薬部外品は対象外となっております。
|
|
|
| |
|
|
| |
Ⅱ−Q61. |
評価結果の意見・情報の募集が終了してからどの程度の日数で最終的な評価結果が決定されるのですか。(平成19年11月) |
|
Ⅱ−A61. |
食品健康影響評価に関する審議結果(案)についての御意見・情報の募集終了後、ほぼ1ヶ月以内に食品安全委員会における審議を経て評価結果が決定され、同日付で厚生労働省などのリスク管理機関に通知しています。
ただし、寄せられた御意見によっては再度専門調査会において審議されることもあるため、これまで最長で約3ヶ月かかった例もありました。
(参考)
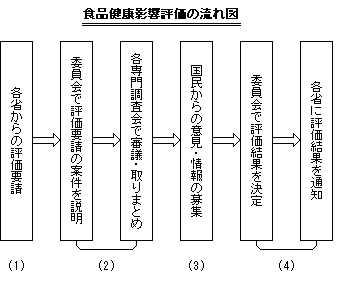
リスク管理機関から食品健康影響評価(リスク評価)に関する意見を要請された案件については、通常、以下に示す流れで審議が行われます。 |
|
|
 |
|
|
(1)各省から食品安全委員会に食品健康影響評価(リスク評価)が要請(諮問)されます。
(2)食品安全委員会では、まず委員会会合で評価要請の趣旨について説明を受けた後、専門調査会に付託し、審議が行われます。
例えば、農薬や食品添加物などの化学物質を評価する場合、専門調査会では、
[1]その物質の一般的な毒性を調べる90日反復投与毒性試験や1年間反復投与毒性試験
[2]胎児に奇形が生じるかどうかを調べる催奇形性試験
[3]発がん性があるかどうかを調べる発がん性試験
[4]アレルギー性を調べる抗原性試験
[5]遺伝子を傷害するかどうか調べる変異原性試験
などの様々な試験成績等を踏まえ、その物質の安全性を科学的に評価します。評価の結果は、例えば、1日摂取許容量(ADI)※として示されます。
(3)その審議結果(案)について委員会で審議を行った後、原則として広く国民から30日にわたって意見・情報の募集を行います。 |
|
|
(4)寄せられた意見・情報を踏まえ、専門委員の意見を聴いて、必要に応じ修正を行った後、最終的に食品安全委員会において審議の上、評価結果を決定し、各省に通知することとなります。以上の審議状況については当委員会のホームページでも知ることができます
( http://www.fsc.go.jp/hyouka/index.html)。 |
|
|
※
一日摂取許容量(ADI: Acceptable Daily Intake)とは、ヒトがある物質の一定量を毎日一生涯にわたって摂取し続けても、現時点でのあらゆる知見からみて、健康への悪影響がないと推定される一日当たりの摂取量のことです。
通常、体重1kg当たりの物質量で示されます(○○mg/kg体重/日)。
例えば、農薬、添加物では、リスク評価の結果、定められる一日摂取許容量(ADI)に基づいて、リスク管理機関がその水準を超えないよう食品ごとの残留基準、使用基準などを定めています。 |
|
|
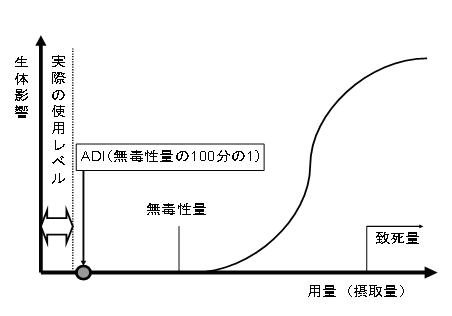
摂取量と生体影響の一般的な関係 |
|
|
| |
Ⅱ−Q69. |
ホームページに掲載されている資料を読むと、一日摂取許容量(ADI)の説明に、「毎日一生食べ続けても健康に悪影響が生じないと推定される量」という表現がありますが、若い人と高齢者では食べ続ける期間の長さが違うのになぜ同じ値が設定されているのでしょうか。(平成20年10月) |
|
Ⅱ−A69. |
食品の残留農薬等の健康影響評価では、さまざまな動物を使って安全性試験を行い、各試験におけるその動物に悪影響を示さない量(無毒性量)を求めます。試験では、その残留農薬等をほぼ一生にわたって継続的に摂取することによる健康への影響についても調べます。
次に、各試験の無毒性量のうちで最も低い無毒性量をもとに、一日摂取許容量(ADI)を設定します。ADIは、『無毒性量÷安全係数※(通常100)』で算出されます。
また、体内に蓄積性がないかも調べています。化学物質ごとの特性により時間の長短はありますが、他の物質に変化したり体外に排出されたりして、本来の性質や体内の残留量は時間とともに変化、減少していきます。
これらのことからADIは、期間の長短に関係なく「人が、毎日、一生涯、食べ続けても、健康に悪影響がでないと考えられる量」として設定されています。
※安全係数
実験動物と人間の「種の差」や人間の性別、年齢、健康状態などの「個人差」を考え、さらに安全を考慮した係数のこと。通常100を用いるが試験データの質によっては500、1000、1500など、さらに高い値が使われる。 |
|
|
| |
Ⅱ−Q70. |
ADI(一日摂取許容量)は、NOAEL(無毒性量)を安全係数※で割ることで求められるとのことですが、NOAELとはどのように決めるのですか。(平成20年11月) |
|
Ⅱ−A70. |
NOAEL(無毒性量)とは、動物を使ってある物質について何段階かの投与量を用いて毒性試験を行い、何ら有害な影響が認められなかった最大の投与量のことです。
各種動物(マウス、ラット、ウサギ、イヌ等)を使った長期間投与時の毒性試験や発がん性、胎児への影響等の試験において得られた個々のNOAEL(無毒性量)の中で最も小さい値を、ADI設定に使います。
使用すべき動物種なども含めた試験方法に関しては、ガイドラインが定められています。
ガイドラインの例:「農薬の登録申請に係る試験成績について」
(平成12年11月24日付け12農産第8147号農林水産省農産園芸局長通知、 http://www.acis.famic.go.jp/shinsei/index.htm
参照)
なお、動物試験において何段階かの投与量が設定されますが、適切な投与量設定のための予備試験が行われ、NOAEL(無毒性量)を得るように考慮されています。
※安全係数
実験動物と人間の「種の差」や人間の性別、年齢、健康状態などの「個人差」を考え、さらに安全を考慮した係数のこと。通常100を用いるが試験データの質によっては、さらに高い値が使われる。 |
|
|
| |
Ⅱ−Q75. |
食品安全委員会が実施している食品健康影響評価(リスク評価)に用いる実験データなどは、どのようにして得るのですか。(平成22年2月) |
|
Ⅱ−A75. |
リスク評価には、厚生労働省等のリスク管理機関からの要請を受けて行うものと、食品安全委員会が自らの判断で行うもの(自ら評価)がありますが、分野ごとに食品安全委員会によって食品健康影響評価の基準が定められており、評価基準に基づいて中立公正な立場で厳正なリスク評価が行われています。
1. |
要請に基づくリスク評価の場合、厚生労働省、農林水産省や消費者庁など、リスク評価を要請した機関から提出されたデータ(実験データや国内外の論文、JECFA※1やJMPR※2等の評価データ)等を整理して、それをもとに評価を行うことが国際的にも原則となっています。評価にあたっては、まず、各分野の専門家からなる専門調査会においてデータ類の信頼性などについて検討し、必要な場合は、評価を要請したリスク管理機関に追加のデータ等を出すよう求めることになります。
また、動物実験を主体とした安全性試験を適切に実施し、データの信頼性、中立性を確保するため、優良試験所基準(GLP:Good
laboratory Practice)が定められており、農薬や食品添加物の実験データは、この基準を満たしたテスト機関で、定められた手順によって行われることが求められています。
|
2. |
「自ら評価」の場合、審議の際には、第三者機関に委託して行った研究事業や調査事業による調査結果、収集整理を行った国内外の科学論文の他、評価案件に応じて食品安全委員会が独自に集めた様々なデータをもとにしてリスク評価を行います。
例えば、最近8カ国分のリスク評価がまとまった、「BSEが発生していない国を対象とした、我が国に輸入されている牛肉、牛内臓のリスク評価」では、平成19年度に調査事業で行った「我が国に輸入される牛肉等に係る食品健康影響評価に関する調査」に基づき、評価対象国とした国に評価に必要な調査項目を質問票として送付し、うち、回答のあった8カ国(メキシコ、チリ、バヌアツ、パナマ、コスタリカ、ブラジル、ハンガリー、ニカラグア)からの情報に加え、当委員会が独自に各国の関係法令や関連する貿易統計、最新科学論文などを調査、収集し、データの信頼性を確保した上で、評価を行いました。 |
※1 |
JECFA(Joint
FAO/WHO Expert Committee on Food Additives)FAO/WHO合同食品添加物専門家会議:FAO
とWHO が合同で運営する専門家の会合。FAO、WHO、それらの加盟国およびコーデックス委員会に対する科学的な助言機関として、添加物、汚染物質、動物用医薬品などの安全性評価を行います。 |
※2 |
JMPR(Joint
FAO/WHO Meeting on Pesticide Residues)FAO/WHO合同残留農薬専門家会議:FAO
とWHO が合同で運営する専門家の会合。FAO、WHO、それらの加盟国およびコーデックス委員会に対する科学的な助言機関として、農薬の一日摂取許容量(ADI)
や食品由来の残留農薬の摂取推定量について科学的評価を行います。 |
|
|
|
|
| |
Ⅱ−Q80. |
放射性物質の食品健康影響評価の概要を教えてください。(平成23年12月) |
|
Ⅱ−A80. |
○ |
食品健康影響評価として、生涯における追加(※1)の累積の実効線量がおおよそ100mSv 以上で放射線による健康影響の可能性(※2) |
○ |
そのうち小児の期間については、感受性が成人より高い可能性(甲状腺がんや白血病)(※3) |
○ |
100mSv 未満の健康影響について言及することは、現在得られている知見からは困難 |
|
|
(※1) |
自然放射線(日本平均約1.5mSv/年)や、医療被ばくなど通常の一般生活において受ける放射線量を除いた分 |
(※2) |
健康影響が見いだされる値についての疫学データは錯綜していたが、食品分野のリスク分析の考え方(科学的知見の確実性や、健康影響が出る可能性のある指標のうち最も厳しいものの重視等)に基づいておおよそ100mSv と判断したもの |
(※3) |
被ばく線量の推定等に不確実な点があるが、チェルノブイリ原発事故の際、周辺住民の小児について、白血病のリスクが増加した、被ばく時の年齢が低いほど甲状腺がんのリスクが高い等の疫学データ有り。 |
|
これを受けて、食品中の放射性物質の規制値について、厚生労働省では、来年4月を目途に、一定の経過措置を設けた上で、許容できる線量を年間1mSvに引き下げることを基本として、薬事・食品衛生審議会において検討されているところです。
なお、同審議会では、食品中の放射性物質のモニタリング検査で得られた測定データと食品摂取量のデータを用いて、流通食品由来の被ばく線量を推計していますが、これによると、自然放射性物質の摂取による年間実効線量が0.4mSv程度であるのに対し、追加の被ばく線量は0.1mSv程度(※4)と推計されています。 |
|
(※4) |
モニタリングで得られた測定データの中央値の場合
|
|
|
|
|
|
| ii |
化学物質系(添加物・農薬・動物用医薬品等) |
|
| |
Ⅱ-Q2. |
食品添加物としてのコウジ酸の発がん性が食品安全委員会によって評価されましたが、こうじ菌を用いて製造されている食品は安全と考えていいですか。(平成15年8月) |
|
Ⅱ-A2. |
7月24日に、食品安全委員会で評価された食品添加物「コウジ酸」は、味噌、しょう油等の製造に用いられる麹菌を培養して得られる抗菌作用を持った物質です。もちろんコウジ酸と麹菌は同じものではありません。
一方、麹菌を用いて製造される、味噌、しょう油、酒等の食品については、
|
(1) |
我が国の伝統食品として長い歴史を有するものであること、 |
|
|
(2) |
麹菌を用いて製造される過程において、コウジ酸も産生されるが、食品中の微生物、酵素等によって分解されると報告されていること、 |
|
|
(3) |
動物実験で腫瘍の発生が見られた濃度に比べ、製品中のコウジ酸濃度は現時点においては極めて低いものであること、
|
などから、特段の措置を講じる必要はないとされています。 |
|
|
| |
Ⅱ-Q6. |
輸入野菜の残留農薬の安全性に不安があります。農薬に関する食品健康影響評価はどのように行われているのですか。(平成15年10月) |
|
Ⅱ-A6. |
農薬の食品健康影響評価では、 【2】Q2
と同様に種々の安全性試験の成績を評価してADIを設定しています。なお、食品衛生法では、一日あたりの農薬摂取量がADIを超えないよう作物ごとに残留農薬基準が設定されております。この残留農薬基準は、国産・輸入を問わず我が国で流通する食品を対象としており、いずれもが食品衛生法に基づく規制を受けることとなります。残留農薬基準が設定された食品については、流通における抜き取り検査が地方自治体の食品衛生監視員により実施されており、基準を超えるものは廃棄や回収等が行われます。さらに、輸入品については、全国31箇所の港や空港にある厚生労働省検疫所でも審査や検査が行われています。食品の種類毎に輸入量、違反率等を勘案して計画的なモニタリング検査が実施されていますが、違反の可能性の高い食品については、厚生労働大臣の検査命令による検査が実施され、適法と判断されたものが輸入される仕組みとなっています。 |
|
|
| |
Ⅱ-Q10. |
加工食品中の添加物の安全性について教えて下さい。(平成15年12月) |
|
Ⅱ-A10. |
添加物は、種々の試験で安全性が確認された上で指定を受けています。また、例外的に指定を受けずに使用が認められている既存添加物は、長年の食経験があるものです。いずれについても、新たに毒性を疑わせる知見等が得られた場合には、必要に応じて安全評価を行うことになります。
また、加工食品中の添加物については、国内に流通しているものは保健所、海外から輸入されたものについては検疫所で基準に合った添加物が使用されているかどうかの検査等による確認が行われています。 |
|
|
| |
Ⅱ-Q11. |
天然由来の食品素材やそれらの加工品の安全性について教えて下さい。(平成15年12月) |
|
Ⅱ-A11. |
食品として摂取できるものについては、特に事前の安全性の審査等は行われていません。ある食品について安全性を疑われる知見等が得られた場合には、必要に応じて安全性の評価を行い、その結果に基づき、厚生労働省において速やかに必要な措置が講じられることになります。 |
|
|
| |
Ⅱ-Q14. |
化学分解法により再生されたポリエチレンテレフタレート(PET)を主成分とする合成樹脂製の容器包装の安全性が評価されましたが、わかりやすく教えて下さい。
(平成16年4月) |
|
Ⅱ-A14. |
今回、食品健康影響評価を行った「化学分解法により再生したポリエチレンテレフタレート(PET)を主成分とする合成樹脂製の包装容器」とは、リサイクルのため分別回収された使用済みPET等を化学的に分解し、原料であるテレフタル酸に戻した上で、再度、合成を行いPET樹脂としたもので製造される容器包装のことです。
この再生PET樹脂で製造された容器包装の安全性については、米国FDA、ドイツBfR等のリサイクルプラスチックに関するガイドライン等を参考に、評価を実施しました。
その結果、回収PETの品質、リサイクル工程、再生PETの品質等で安全性が懸念される結果は認められなかったことから、現在のPETと同じ用途内において、食品に直接接触する容器包装として使用することは可能であると結論づけたものです。
なお、評価の詳細については、 こちらをご参照下さい。 |
|
|
| |
Ⅱ-Q15. |
食品添加物、農薬などの安全性確保のためどのような毒性試験がなされているのですか。(平成16年5月) |
|
Ⅱ-A15. |
食品安全委員会においては、農薬、食品添加物などの食品健康影響評価を実施しています。評価は毒性試験成績等に基づき行われますが、評価の過程で関連する文献等の追加収集や毒性試験の追加実施を求める場合もあり得ます。
化学物質の評価においては、評価物質の特性を踏まえて、必要な試験データの精査が行われます。一般的には、その物質の一般毒性を調べる試験として、ネズミ等の実験動物に評価物質等を一回投与して急性の毒性影響を調べる試験(急性毒性試験)、評価物質等を一定期間投与し、発育への影響や肝臓等の臓器や神経系等への毒性影響を調べる試験(反復投与毒性試験)の他、特殊の毒性を調べる試験として、
|
(1) |
妊娠させた実験動物に評価物質を投与し、生殖に及ぼす影響や催奇形性等の影響があるかどうかを調べる試験(繁殖試験、催奇形性試験) |
|
|
(2) |
がんの発生があるかどうかを調べる試験(発がん性試験) |
|
|
(3) |
アレルギー原性(抗原性)を調べる試験(抗原性試験) |
|
|
(4) |
遺伝子を傷害するかどうか調べる試験(変異原性試験) |
などがあります。
試験期間については、試験の性質の他、評価物質、実験動物の種類等により異なりますが、発がん性の試験等では、2年の長期にわたり行われるものもあります。
|
|
|
| |
Ⅱ-Q17. |
重金属の一日許容摂取量について教えてください。(平成16年5月) |
|
Ⅱ-A17. |
意図せず食品に含まれる重金属(汚染物質)については、毒性試験等の各種データに基づくリスク評価により耐容摂取量(※1)が設定されているものがあります。
例えば、カドミウムは、FAO/WHO合同食品添加物専門家会議(※2)において、暫定耐容週間摂取量を7μg/kg体重/週とされております。
なお、現在、当委員会において、厚生労働大臣から意見要請(「食品からのカドミウム摂取の現状に係る安全性確保について」)を受け、カドミウムの耐容摂取量の設定等の検討を行っているところです。
|
(※1) |
耐容摂取量とは、重金属等に関する指標として用いられ、環境汚染物質等の非意図的に混入する物質について、生涯にわたって摂取しても健康に対する有害な影響が現れないと判断される摂取量。 |
|
|
(※2) |
FAO/WHO合同食品添加物専門家会議とは、国連食糧農業機関(FAO)と世界保健機関(WHO)が合同で運営している専門家により構成される機関であり、食品添加物や環境汚染物質等のリスク評価を行っています。 |
|
|
|
|
| |
Ⅱ-Q18. |
アカネ色素に係る評価についてわかりやすく説明してください。(平成16年6月) |
|
Ⅱ-A18. |
厚生労働大臣から平成16年6月18日付けで評価を依頼されたアカネ色素に係る食品健康影響評価について、7月2日に開催された第52回食品安全委員会において審議を行ない、以下のとおり食品健康影響評価の結果を取りまとめ、厚生労働大臣に通知しました。
「腎臓以外の臓器の所見等について、今後とも情報収集が必要であるが、提出された資料からは、遺伝毒性及び腎臓への発がん性が認められており、アカネ色素についてADIを設定できない。」
すなわち、アカネ色素について安全に摂取できる量を示せないという結果です。
詳細については、食品安全委員会ホームページ
( http://www.fsc.go.jp/hyouka/maddercolor.pdf)をご参照ください。
なお、厚生労働省においては、食品健康影響評価の結果の通知を受け、薬事・食品衛生審議会の意見を踏まえ、食品衛生法及び栄養改善法の一部を改正する法律(平成15年)附則第2条の2第1項に基づき、7月9日にも、既存添加物名簿からアカネ色素を消除し、当該食品添加物及びこれを含む食品の製造・販売・輸入等を禁止することを予定しています。
詳細については、厚生労働省ホームページ
http://www.mhlw.go.jp/topics/bukyoku/iyaku/syokuten/040705/index.html)
をご参照ください。
|
|
|
| |
Ⅱ-Q20. |
英国食品基準庁がヒジキに無機ヒ素が含まれているとして、食べないように注意喚起していますが、ヒジキの安全性について教えてください。(平成16年7月)(平成22年8月更新) -NEW- |
|
Ⅱ-A20. |
ヒジキに無機ヒ素が、他の食品に比べ比較的高濃度で含まれていることが文献などで報告されています。ヒジキについては、伝統的な食材として古くから食べられておりますが、これまでにヒジキを食べてヒ素中毒を起こすなど健康に悪影響が生じたとの報告はありません。ヒジキを極端に多く食べない限り、健康上のリスクが高まるとは考えられません。
また、海そう類はミネラルに富む食品であり、健康維持のためには、これらをバランスよく食べることが重要です。
(参考)
1 ヒジキ中のヒ素に関するQ&Aが、厚生労働省のホームページ
( http://www.mhlw.go.jp/topics/2004/07/tp0730-1.html)に掲載されています。
2 ヒジキ中のヒ素に関する食品安全委員会からのこれまでの掲載情報については、 食品安全モニターからの報告(平成18年8月分)の19ページを御覧下さい。
|
|
|
| |
Ⅱ-Q24. |
「加工食品中のアクリルアミドについて」がホームページ上に掲載されましたが、掲載の主旨と内容のポイントを教えて下さい。(平成16年10月) |
|
Ⅱ-A24. |
食品安全委員会では、食品の摂取と健康影響に関することなどを広く国民に情報提供する一環として、ファクトシートの作成に取り組んでいます。
ファクトシートとは、対象となる物質や事柄について、科学的な知見に基づいて分かりやすく整理したものです。今回作成したアクリルアミドについては、世界各国で調査研究が進められていることから、最近の状況について整理し公表することとしたものです。
加工食品中のアクリルアミドは遺伝毒性や発がん性が懸念される物質であり、デンプンを多く含む食材を高温で加熱した食品に生成されるということを、2002年4月にスウェーデン政府が発表して以降、我が国を含め世界各国で研究が進められています。
アクリルアミドについては、極めて高用量を投与した動物実験では、その影響が確認されていますが、ヒトが食品中に含まれる極めて微量のアクリルアミドを摂取した際の影響については、未だ明らかになっていません。食品中に含まれる微量のアクリルアミドが、ヒトに対して影響を示すのかどうかについて調査研究が進められています。
また、2004年3月に開催された第36回コーデックス委員会食品添加物汚染物質部会(CCFAC)では様々な食品中のアクリルアミド含有量が示されました。
この中では、多くの食品にアクリルアミドが確認されておりますが、ジャガイモをゆでたり蒸したりしても生成は確認されておらず、フライドポテトやポテトチップスなどの素揚げ調理したものに生成が見られます。
アクリルアミドは高温で加熱した様々な加工食品に含有することが分かっていますが、現在の食生活を直ちに見直す必要はないと考えられます。大切なことは、
[1]十分な果実、野菜を含む様々な食品をバランスよく取る
[2]炭水化物の多い食品を必要以上に長時間、高温で加熱しない
[3]生のジャガイモを低温で保存するとデンプンの一部が糖へと変化するため、冷蔵庫に保存した生のジャガイモは、揚げ物などの高温加熱を避ける
ことです。
詳細はホームページ( http://www.fsc.go.jp/sonota/acrylamide-food160930.pdf)に掲載しておりますのでご参照下さい。 |
|
|
| |
Ⅱ-Q26. |
食品添加物としてのグルコン酸亜鉛の評価結果について教えてください。(平成16年10月) |
|
Ⅱ-A26. |
グルコン酸亜鉛は、亜鉛強化の目的で昭和58年に食品添加物として指定され、現在、母乳の代替となる粉乳等の食品への使用のみが認められています。今般、国民健康・栄養調査結果等から、小児を除く幅広い年齢層において亜鉛が不足していることが指摘されていることから、厚生労働大臣から通常の食品の形態をしていない液剤、カプセル、顆粒、錠剤及び粉末に使用できるよう添加物の使用基準の改正を行うにあたり、食品健康影響評価の依頼があったところです。
評価の結果、亜鉛としての摂取を評価することが適切であるとされ、また亜鉛はヒトにとって、必須元素であることを踏まえ、グルコン酸亜鉛の許容上限摂取量(※参照)は、亜鉛として成人一人あたり30
mg/日と評価されました。また、乳幼児〜小児については、通常の食生活における亜鉛の摂取量が既に所要量を満たしていると考えられることから、サプリメントとして摂取することがないよう適切な注意喚起が行われるべきであるとされたところです。
なお、この評価結果を踏まえて、亜鉛についてサプリメント等の栄養機能食品の表示にあたっては「乳幼児・小児は本品の摂取を避けてください」との注意喚起表示が必要とされました。
詳細はホームページ( http://www.fsc.go.jp/hyouka/hy-gluconatezn-hyouka.pdf)に掲載しておりますのでご覧下さい。
※ほとんど全ての人々に対して健康上の有害影響とはならないと考えられる日常的な栄養摂取量の最大値。 |
|
|
| |
Ⅱ-Q28. |
添加物の安全性がどのように確保されているか、リスク評価との関係など具体的に教えてください。(平成16年11月) |
|
Ⅱ-A28. |
食品添加物は、厚生労働大臣が人の健康を損なうおそれがない場合として定めるもの以外は使用が禁止されており、安全性が確認され、かつ有用性があるものが指定されています。
また、食品添加物の品質の確保や不適切な使用を防ぐため、必要に応じ個別に一定の品質を確保するための成分規格や使用目的、対象食品や使用量といった使用基準などが設定されています。
具体的には、食品安全委員会が安全性について食品健康影響評価を行い、単回投与毒性試験、反復投与毒性試験、繁殖毒性試験、発がん性試験、遺伝毒性試験などの動物実験等の結果を踏まえて、人が生涯にわたり毎日摂取し続けたとしても、健康上の問題を生じないとされる一日当たり、体重1kgあたり摂取量、すなわち一日摂取許容量(ADI)を設定します。
このADIに基づき、リスク管理機関である厚生労働省において、添加物としての指定及び規格基準の設定が行われます。
また、国内に流通しているものは保健所、海外から輸入されたものについては検疫所で基準に合った添加物が使用されているかどうかの検査等による確認が行われています。 |
|
|
| |
Ⅱ-Q31. |
食品添加物のリスク評価が、様々な毒性試験の成績等に基づいて行われていることを知りましたが、その試験はどのような機関で行われているのか教えて下さい。(平成17年1月) |
|
Ⅱ-A31. |
毒性試験については平成8年3月22日付け衛化第29号厚生省生活衛生局長通知「食品添加物の指定及び使用基準改正に関する指針について」
( http://www.mhlw.go.jp/topics/bukyoku/iyaku/syokuten/960322/index.html)において、食品添加物の指定及び使用基準改正の要請書に添付すべき資料の作成上の一般的注意として「添付資料を作成するために必要とされる試験は、試験成績の信頼性を確保するために必要な施設、機器、職員等を有し、かつ適正に運営管理されていると認められる試験施設において実施されなければならない」とされています。
具体的には、化学物質GLP(優良試験施設規範)適合確認施設などで実施された試験成績が該当します。
なお、GLP(優良試験施設規範)とは、各種安全性試験成績の信頼性を確保するための手段として、試験施設が遵守すべき基本的な事項を定めたもので、国がその規範に基づいてその施設の適合確認を行うものです。
また、前述の指針において、要請に係る食品添加物がその品質、安全性又は有効性を有することを疑わせる資料については、当該資料の信頼性等にかかわらず、提出しなければならないとされています。
|
|
|
| |
Ⅱ-Q34. |
「食品に残留する農薬等に関するポジティブリスト制度の導入について」の意見が発表されましたが、その趣旨について教えてください。(平成17年5月) |
|
Ⅱ-A34. |
現行では、食品に残留する農薬、動物用医薬品及び飼料添加物について、原則自由の中で、残留基準が定められている農薬等が残留基準を超えている場合、その食品の流通を禁止する、いわゆるネガティブリスト制度がとられています。
今後は、残留基準を設定し、これが定められていない農薬等が一定量以上含まれる食品の流通を原則として禁止する制度、いわゆるポジティブリスト制度が平成15年の食品衛生法等の一部を改正する法律により、平成18年5月までに導入することとなっており、厚生労働省で本制度の導入に向けた検討がなされているところです。
本制度が適正に運用されれば、これまで以上に食品に残留する農薬等の管理の徹底が図られ、食品の安全性に貢献するものと考えます。
このため、食品の安全性確保の観点から、その運用が適正に図られるよう、去る4月28日に、厚生労働省に対して意見を述べることとしたものです。
具体的には、今後、当該施策を推進する上で食品の安全性の確保を図る観点から留意すべきと考えられる事項として
①厚生労働大臣が暫定的に定めることとしている農薬等の食品に残留する量の限度(暫定基準)を設定すべき物質について再点検すること
②暫定基準については、優先的にリスク評価を実施すべき物質についての考え方を整理した上で、リスク評価計画を策定し、委員会の了承を得ること
などを指摘したところです。
詳しい内容は、食品安全委員会ホームページ
( http://www.fsc.go.jp/iinkai/positivelist_170428.pdf)をご覧下さい。 |
|
|
| |
Ⅱ-Q36. |
残留農薬のADIの設定は、胎児への影響についても考慮されているのですか。(平成17年6月) |
|
Ⅱ-A36. |
残留農薬のADIの設定にあたっては実験動物を用いた様々な毒性試験を行っていますが、2世代にわたって検体を投与して、親動物の摂取した農薬が児動物に及ぼす影響を調べる繁殖試験や、妊娠した母動物に検体を投与し、胎児への影響を調べる催奇形性試験も行っています。このような次世代への影響も含め、様々な影響を調べる試験を行った結果、何ら毒性所見が認められなかった最大摂取量を、安全係数(通常100)で割ってADIは決定されます。
よって、残留農薬のADIは、胎児への影響についても考慮して設定されています。 |
|
|
| |
Ⅱ-Q37. |
魚介類等に含まれるメチル水銀の評価結果案について意見募集が行われていますが、この評価結果案のポイントについて教えてください。(平成17年6月) |
|
Ⅱ-A37. |
魚介類等に含まれるメチル水銀に係る食品健康影響評価(案)については、厚生労働省が魚介類等に含まれるメチル水銀に係る妊婦等を対象とした摂食に関する注意事項の見直しを検討するため、(1)メチル水銀の耐容摂取量の設定、(2)乳幼児等がハイリスクグループに含まれるかの2点についての評価を厚生労働省から依頼されたものです。
通常の食生活をしている人に対しては1973年に厚生労働省が行った従来の評価結果※1が適用されることになりますが、今回の食品健康影響評価は、メチル水銀は胎盤を通して容易に胎児へ移行し、その中枢神経系へ影響を及ぼすことから、どのくらいのメチル水銀摂取量ならば胎児に影響を及ぼさないかを検討しています。
結論として、ハイリスクグループは胎児で、耐容摂取量の対象者は胎児を保護することを念頭に妊娠している方もしくは妊娠している可能性のある方とされ、耐容週間摂取量※2は2.0μg/kg体重/週とされました。
なお、乳児は母親が通常の食生活をしていれば母乳中のメチル水銀は十分低濃度となること、幼児は成人と同様にメチル水銀を体内から排出することから、乳幼児はハイリスクグループから外されました。
※1: |
1973年の厚生労働省により設定された耐容1週間摂取量は、0.17mg/人/週(50kg/人で計算すると3.4μg/kg体重/週) |
|
※2: |
耐容週間摂取量は、食品から摂取される可能性のある汚染物質に対して人が許容できる一週間当たりの摂取量である。 |
|
|
|
| |
Ⅱ-Q39. |
以前、アルミニウムがアルツハイマー発症に関連があるというニュースを聞きましたが、その後新しい科学的知見が出ましたか。(平成17年7月) |
|
Ⅱ-A39. |
現在、アルミニウムとアルツハイマー発症の関係については、関連があるとする説と関連を否定する説が存在し、WHO(世界保健機関)のクライテリア(基準)194(1997年)では、関連があるかどうか確定できないとしています。その後クライテリアで取り上げられていないことを見ると、有力な知見は出ていないようです。 |
|
|
| |
Ⅱ-Q40. |
ハイリスクグループにかかるメチル水銀の耐容週間摂取量について、2003年にJECFAが1.6μg/kg体重/週の評価を行っていますが、今回の「食品健康影響評価」で食品安全委員会が算出した2.0μg/kg体重/週との違いについて教えてください。(平成17年7月) |
|
Ⅱ-A40. |
当委員会は、JECFAと同様に、フェロー諸島とセイシェル共和国における研究を基に評価していますが、安全を見越した毛髪水銀濃度と判断した数値および不確実係数の取り方の違いによって、JECFAとは異なる耐容週間摂取量を設定しています。
不確実係数については、通常、動物実験データを用いて人への毒性を推定する場合、動物と人との種差として「10倍」、さらに人と人との個体差として「10倍」、全体として「10×10=100」を用いる場合が多いのですが、今回の評価では、使用するデータが動物実験ではなく、人のデータであることなどから、以下の通りとしています。
毛髪水銀濃度と血中水銀濃度の比について、調査データの変動幅から、その幅を2とし(JECFAと同じ)、またメチル水銀が排泄される時の代謝の変動データから、その変動幅を2(JECFAは3.2)としました。その結果、不確実係数は、4を採用しています。
これは、JECFAが耐容週間摂取量の評価を行った際、不確実係数の数値を小さくする余地が残っていると指摘していることを考慮して検討を行ったものです。
以上の点から、JECFAの耐容週間摂取量(1.6μg/kg体重/週)とは異なる数値として2.0μg/kg体重/週を算出しました。
なお、詳しくは、食品安全委員会ホームページ( http://www.fsc.go.jp/senmon/osen/o-dai10/index.html)を参照下さい。
|
|
|
| |
Ⅱ-Q46. |
ポジティブリスト制度が5月29日から施行されましたが、今後、食品安全委員会ではどのような取組をしていくのでしょうか。(平成18年5月) |
|
Ⅱ-A46. |
食品中に残留する農薬、動物用医薬品及び飼料添加物(以下「農薬等」という。)については、これまで厚生労働省が、食品衛生法第11条に基づき残留基準を設定し、その安全確保を図ってきたところであり、これまでは、残留基準が設定されていない農薬等が食品から検出されても、その食品の販売等を禁止するなどの措置を行うことができませんでした。しかし、今後は、本制度の導入により、一定の量を超えて農薬等が残留する食品の販売等が原則禁止されることとなります。
厚生労働省から食品安全委員会に提出された「食品に残留する農薬等に関するポジティブリスト制度の導入について(平成17年11月28日付厚生労働省発食安第1128001号)」によれば、厚生労働省は食品安全委員会に対し、今後5年間を目途に758の農薬等の食品健康影響評価の依頼をするとしており、評価作業は、年平均150物質程度となる見込みとなっています。
このほかに、一律基準の設定及び対象外物質の設定のものもあり、こうした数多くの評価を円滑に進めるため、暫定基準が設定された農薬等のリスク評価においては、現行の農薬等の評価方法を参考にしつつ試行的なものとして実施手順を定め、毒性等の評価を行うこととしております。この実施手順(案)につきましては、本年5月11日から6月9日までの間、国民の皆様からの御意見・情報の募集を行っているところです。
詳細につきましては、食品安全委員会のホームページ
(http://www.fsc.go.jp/iken-bosyu/pc_kijyun_chemicals180511.html)を御覧ください。 |
|
|
| |
Ⅱ-Q48. |
妊娠中の飲酒と胎児性アルコール症候群との関係を教えて欲しい。(平成18年7月) |
|
Ⅱ-A48. |
妊娠中にアルコールを摂取した女性から生まれた子供に、
|
・ |
特徴的な顔貌(小さな目、薄い唇など) |
|
|
・ |
発育の遅れ |
|
|
・ |
中枢神経系の障害(学習、記憶、注意力の持続、コミュニケーション、視覚・聴覚の障害など) |
などの先天異常が見られる場合があり、これを「胎児性アルコール症候群(FAS)」と呼びます。妊婦が摂取したアルコールは胎盤を通じて胎児の体に入りますが、胎児にそのアルコールがどのように作用してFASを引き起こすのかについては、胎児の発育過程そのものに不明な点が多いことや、妊娠中に飲酒した時期、飲酒の頻度や飲酒量、母親と胎児の健康状態や遺伝的素因など様々な要因が関係することから十分に解明されていません。
しかし、最近の研究から、アルコールの代謝に伴って発生する物質が胎児の細胞を傷つけたり、神経細胞の正常な発育に必要ないくつかの物質の作用をアルコールが阻害してしまう可能性など、様々な原因が複雑に絡み合いながらFASの発生に関与しているものと考えられています。
アルコールによる胎児の障害は妊娠中であれば何時でも起きる可能性があります。また妊娠中に飲酒しても安全なアルコールの量は明らかにされておらず、妊娠中の飲酒はその量や時期にかかわらず胎児に悪影響を与える恐れがあるとされています。
詳細につきましては、食品安全委員会ホームページの「ファクトシート」→「妊婦のアルコール飲料の摂取による胎児への影響」をご覧下さい。
( http://www.fsc.go.jp/sonota/54kai-factsheets-alcohol.pdf) |
|
|
| |
Ⅱ-Q49. |
食品安全委員会が発行している季刊誌「食品安全vol.9」の特集記事「残留農薬等のポジティブリスト制度の導入における食品安全委員会の役割について」を読みました。この中で、「今回は、あらかじめリスク評価を行ういとまがなかった」ために、通常と異なる評価の手順を採ることとなったとありますが、なぜいとまがなかったのでしょうか。(平成18年8月) |
|
Ⅱ-A49. |
本来、農薬等の残留基準は、厚生労働省等からの依頼を受けて食品安全委員会がリスク評価を行い、これに基づいて厚生労働省等が残留基準を設定します。
一方、食品安全基本法第11条は、その例外として、「人の健康に悪影響が及ぶことを防止し、又は抑制するため緊急を要する場合で、あらかじめ食品健康影響評価を行ういとまがないとき」には、施策を策定した後にリスク評価を行うことを認めています。
今回新たに実施されることとなったポジティブリスト制度は、食品に使用される農薬等について例外なく残留を規制し、全ての食品の安全を確保する制度です。諸外国においてポジティブリスト制度の導入が進む中で、我が国においても平成15年5月に食品衛生法が改正され、公布後3年以内(平成18年5月末まで)にポジティブリスト制度が導入されることとなりました。
しかし、これまで残留基準が設定されている農薬等は300品目に満たず、ポジティブリスト制度が円滑に導入されるためには、現在世界で使用されている800近くの農薬等について残留基準を設定する必要があります。
他方、これらリスク評価を行うには、まず評価に用いる毒性試験成績等の資料を収集する等の手続きを経て慎重に行うことが必要であり、かなりの期間を要することが想定されました。
そのため、暫定的な基準であってもこれを設定し規制を開始することが食品の安全性確保につながるとの観点から、制度の導入を優先させ、農薬取締法により使用が認められている農薬や、国際基準であるコーデックス基準などの科学的な評価に基づく残留基準が設定されている758の農薬等について、これらの基準を参考に暫定的な基準を設定することとしたものです。
そして、食品安全基本法第11条に定める「人の健康に悪影響が及ぶことを防止し、又は抑制するため緊急を要する場合で、あらかじめ食品健康影響評価を行ういとまがないとき」に該当するとして、事後にリスク評価を行うこととしました。
なお、食品安全委員会は、厚生労働省がリスク評価に先立って当該制度を導入するに際しては、その導入の方針等の説明を求めるとともに、リスク評価を依頼する計画の策定等について厚生労働省に意見を提出しました。そして、厚生労働省が提出した依頼計画を了承するとともに、その対応状況等について報告を受けています。
また、 「食品安全vol.9」の同記事にも書かれているとおり、食品安全委員会は、758農薬等のリスク評価にあたって円滑に評価を進めるための実施手順を定めるとともに、農薬専門調査会の専門委員を15名から38名に増員し、5部会制にするなど評価体制を強化し、作業を進めているところです。 |
|
|
| |
Ⅱ-Q51. |
食品安全委員会では、食品添加物など複数の化学物質を同時に摂取した際のリスク評価をどのように行っているか、教えてください。(平成18年10月)
|
|
Ⅱ-A51. |
食品添加物や農薬等の化学物質等のリスク評価に当たっては、通常個々の評価物質について検討を行います。具体的には、単回投与毒性試験、反復投与毒性試験、繁殖毒性試験、発がん性試験、遺伝毒性試験などの動物実験の成績を評価し、各々の試験について何ら毒性影響が認められなかった量を求めます。各試験で求めた毒性が認められなかった量のうち、最も小さいものをその物質の無毒性量とします。この無毒性量(NOAEL)に、人と動物の違い(種差)や個体差を勘案した安全係数(通常100、場合によっては1000など)を除したものを、人が生涯にわたり毎日摂取し続けたとしても、健康上の問題を生じないとされる一日当たり、体重1kgあたり摂取量、すなわち一日摂取許容量(ADI)として設定します。このADIに基づき、リスク管理機関である厚生労働省において、添加物であれば、添加物の指定及び規格基準を、農薬であれば残留農薬基準を設定します。
複数の化学物質を同時に摂取した場合のリスク評価の検討は行われていませんが、一日摂取許容量の設定の際には適切な安全係数をとっていること、添加物や残留農薬の実際の摂取量は、設定された一日摂取許容量をかなり下回っているとされていることを考慮すると現在のところ特に問題はないものと考えられます。
食品安全委員会では、化学物質の複合影響についてこれまで検討が行われた知見を収集・整理するため、平成18年度の食品安全確保総合調査において、「食品添加物の複合影響に関する情報収集調査」及び「農薬の複合影響評価法に関する文献調査」を実施することとしています。
今後、結果が取りまとめられましたら、ホームページ等により公表することとしています。
http://www.fsc.go.jp/fsciis/survey/show/cho20070330001
|
|
|
| |
Ⅱ-Q55. |
ペットボトル入りの牛乳を販売できるようになるのですか。詳しく教えてください。(平成19年1月) |
|
Ⅱ-A55. |
食品安全委員会では、ポリエチレンテレフタレート(合成樹脂。以下、「PET」という。)を牛乳等の容器包装として追加することについて、平成18年12月11日に厚生労働大臣から食品健康影響評価の依頼を受け、器具・容器包装専門調査会にて調査審議を行いました。
同専門調査会では、以下のことから、容器に入った牛乳等が適切な条件下で管理される限りにおいて、今回申請されたPETは、牛乳等に使用しても十分安全であると判断しました。
|
・ |
今回検討対象となった牛乳等用のPETに使用される原料は、一般食品用の器具・容器包装として既に国内で広く使われているもので、欧米でも使用が認められているものである。 |
|
|
・ |
当該PETに使用できる添加剤は、既に乳及び乳製品の成分規格等に関する省令で使用が認められている3物質で、食品添加物又は日本薬局方医薬品に指定されている。 |
|
|
・ |
4%酢酸や50%エタノールなどの食品擬似溶媒を使用したPETからの金属触媒、添加剤、重金属、蒸発残留物等の溶出量は、大部分が検出限界未満であった。 |
|
|
・ |
牛乳を溶媒としたカドミウム、鉛、アンチモン及びゲルマニウムの溶出試験の結果、溶出量は検出限界未満であった。 |
食品安全委員会では、この審議結果(案)について、平成19年1月18日から同年2月16日までの間、国民の皆様から御意見・情報の募集を行っております。今後は、御意見・情報の募集結果を受け、必要であれば審議結果(案)を修正し、厚生労働省へ通知することとしています。実際に牛乳などの容器包装としてPETの使用を認めるか否かについては、通知を受けて厚生労働省が決めることとなります。
調査審議の詳細につきましては、食品安全委員会ホームページ
( http://www.fsc.go.jp/iken-bosyu/pc_polyethylene_190118.html
)を御覧ください。 |
|
|
| |
Ⅱ-Q56. |
メールマガジン第33号に「水道水(塩素酸)に関する意見・情報の募集について」とありましたが、審議結果(案)の概要を教えてください。(平成19年2月) |
|
Ⅱ-A56. |
わが国の水道水は、浄水処理作業において、必ず塩素の注入による消毒が行われています。この水道水の消毒に最も広く使われている次亜塩素酸を長期間貯蔵しておくと酸化され、「塩素酸(イオン)」( 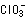 )の濃度が上昇することが分かりました。
このため、水道により供給される水の水質基準に塩素酸を追加することについて、平成18年8月31日付けで厚生労働省からリスク評価の要請がありました。
要請を受けて、食品安全委員会では、汚染物質・化学物質専門調査会合同ワーキンググループにおいて審議を行い、動物実験のデータに基づき、耐容一日摂取量(TDI)(注)を30μg/kg体重/日とする評価結果案をまとめました。
本件については、平成19年2月1日から同年3月2日までの間、意見・情報の募集を行いました。
(注)耐容一日摂取量(TDI:Tolerable Daily Intake):
|
|
人がある物質の一定量を一生涯にわたって毎日摂取し続けても健康への悪影響がないと推定される一日あたりの摂取量。一日摂取許容量(ADI)と類似していますが、その物質が意図的に使われているかどうかで用語を使い分けています。耐容摂取量は、意図的に使用していないのに、食品に残存しているもの(重金属等)や食品を汚染するもの(かび毒など)に設定されます。 |
|
|
|
| |
Ⅱ-Q58. |
PET樹脂は、リサイクルされ、清涼飲料水のペットボトルになっていると聞いたのですが、直接食品に触れる容器包装として使用しても安全なのですか。(平成19年7月) |
|
Ⅱ-A58. |
食品安全委員会では、化学分解法により再生したポリエチレンテレフタレート(PET)を主成分とする合成樹脂製の容器包装 (注1)について、米国の食品医薬品局(FDA)及びドイツ連邦リスク評価研究所(BfR)等のリサイクルプラスチックに関するガイドライン等を参考に、食品健康影響評価を行いました。
その結果、回収PETの品質、再生PETの品質、代理汚染物質除去試験 (注2)等で安全性が懸念される結果は認められなかったことから、現在のPETと同じ用途内において、食品に直接接触する容器包装として使用することは可能であると判断されました。
評価結果の詳細につきましては、下記URLからご参照ください。
http://www.fsc.go.jp/hyouka/hy/hy-pet-hyouka.pdf
http://www.fsc.go.jp/hyouka/hy/hy-67-pet-hyouka.pdf
(注1) |
リサイクルのため分別回収された使用済みPET等を化学的に分解し、原料であるテレフタル酸あるいはビス−2−ヒドロキシエチルテレフタレートに戻した上で、再度、合成を行いPET樹脂としたもので製造される容器包装のこと。 |
|
(注2) |
代理汚染物質除去試験では、利用済みPET原料が化学物質に汚染された場合を想定し、当該再生工程で汚染物質が十分に除去されるかを確認する。
再生プラスチックに含まれる可能性のある化学物質を性質ごとに分類し、各々のカテゴリーから代表的な物質を「代理汚染物質」として選択し、その数種類を組み合わせたもので原料を故意に汚染させた後、再生工程で処理して、その除去性を調べる。 |
|
|
|
| |
Ⅱ-Q59. |
ビタミンAの過剰摂取による影響について教えてください。(平成19年9月) |
|
Ⅱ-A59. |
ビタミンA (※)過剰症には、急性と慢性の症状があり、急性の中毒症状としては、腹痛、悪心、嘔吐、めまいなどの後、全身皮膚落屑(らくせつ)がみられます。慢性の中毒症状としては、全身の関節や骨の痛み、皮膚乾燥、脱毛、食欲不振、体重減少、頭痛などが起こります。そのほかには、催奇形性、骨粗しょう症も知られています。
ビタミンAの過剰摂取は、それを含有する薬剤を大量に服用するか、含有量の多い動物性食品を多量に食べることで起こることがあります。
なお、妊娠3ヶ月以内または妊娠を希望する女性については、胎児への影響を考え、妊婦の推奨量を超えるような過剰摂取をしないよう、特に注意が必要です。
また、ビタミンAの不足による健康障害も知られていますので、バランスよい食事を心がけることが必要です。
食品安全委員会では、平成18年9月、ファクトシート(科学的知見に基づく概要書)「ビタミンAの過剰摂取による影響」を公表しておりますので、詳細についてはファクトシートをご参照ください。
http://www.fsc.go.jp/sonota/factsheet-vitamin-a.pdf
※ |
ビタミンAは、人の視覚、聴覚、生殖等の機能維持、成長促進、皮膚や粘膜などの保持、たんぱく質合成等重要な役割に関与する脂溶性ビタミンの一つです。ビタミンAの主な供給源は、ビタミンAそのものを含む動物性食品や、体内でビタミンAに変換されるカロテン含有量の高い緑黄色野菜で、多く含まれる食品には、「鶏レバー」、「豚レバー」、「ニンジン」、「ホウレンソウ」などがあります。 |
|
|
|
| |
Ⅱ-Q62. |
加工デンプンの安全性について
今回新たに加工デンプンの安全性が評価されたと聞きました。内容について教えてください。(平成19年12月) |
|
Ⅱ-A62. |
食品安全委員会では、糊料、増粘安定剤 ※1及び乳化剤 ※2等の目的で使用される11種の加工デンプン ※3の安全性について評価を行い、「添加物として適切に使用される場合、安全性に懸念がないと考えられ、一日摂取許容量(ADI)を特定する必要はない」との食品健康影響評価を取りまとめ、平成19年11月29日に厚生労働省へ通知しました。
また、評価に際しては、国際機関、米国及びEUにおける評価結果を参照するとともに、各種試験成績等を用いた調査審議を行いました。
なお、今回の評価対象となった11種の加工デンプンについては、わが国において、食品として長い食経験があり、これまでに安全性に関して特段の問題は指摘されておりませんが、米国及びEUにおいては食品添加物として取り扱われており、国際的な整合性を図るため、わが国においてもこれらの品目について食品添加物として指定する必要がありました。
食品健康影響評価の詳細については、以下のサイトに評価書が掲載されていますので、ご確認ください。
http://www.fsc.go.jp/hyouka/hy/hy-tuuchi-modified_starch191129.pdf
※1 |
糊料、増粘安定剤:食品に滑らかな感じや、粘り気を与え、分離を防止し、安定性を向上させるもの。 |
|
※2 |
乳化剤:水と油を均一に混ぜ合わせるもの。 |
|
※3 |
アセチル化アジピン酸架橋デンプン、アセチル化リン酸架橋デンプン、アセチル化酸化デンプン、オクテニルコハク酸デンプンナトリウム、酢酸デンプン、酸化デンプン、ヒドロキシプロピルデンプン、ヒドロキシプロピル化リン酸架橋デンプン、リン酸モノエステル化リン酸架橋デンプン、リン酸化デンプン及びリン酸架橋デンプンに限る。 |
|
|
|
| |
Ⅱ-Q64. |
メタミドホスのADI(一日摂取許容量)を食品安全委員会で設定すると聞きましたが、その経緯について教えてください。(平成20年2月) |
|
Ⅱ-A64. |
平成20年1月に発覚した冷凍食品による食中毒事案については、政府が一体となって対応しています。食品安全委員会では、ホームページなどを通じて、科学的な知見などの情報提供を行うとともに、被害の原因とされる有機リン系殺虫剤のメタミドホスについてリスク評価を行いました。
メタミドホスは、わが国では製造、輸入、使用が禁止されている農薬ですが、海外では一部の農作物に使用されています。ポジティブリスト制度の導入(平成18年)に伴い、メタミドホスを含むほぼ全ての農薬等に残留基準が暫定的に設定されました。食品安全委員会では、順次、これらのリスク評価を進め、その評価結果をもとに、厚生労働省が残留基準の見直しを行っています ※1。
今回の食中毒事案による国民の関心の高まりを受け、厚生労働省からメタミドホスについてリスク評価の要請があり、これを受けて食品安全委員会で評価を行いました。3月6日の食品安全委員会で取りまとめられた評価書案では、様々な動物試験の結果を検討して、メタミドホスのADIを0.0006mg/kg体重/日と設定しました。各種試験結果から、メタミドホスには発がん性、催奇形性 ※2、遺伝毒性 ※3は認められませんでした。
3月6日から4月4日までの間、評価書案について国民の皆様からの意見・情報の募集を行います。その結果を踏まえた最終的な評価結果に基づき、厚生労働省がメタミドホスを規制するための残留基準の見直しを検討することになっています。
なお、メタミドホスを多量に摂取すると、短時間のうちにめまいや吐き気、縮瞳などの症状が起こります。今回の食中毒事案を踏まえて、評価書案では参考値として、「急性参照用量」を示すことにしました。この値は、人が一時的に摂取しても健康に悪影響を及ぼさないと判断される量です。
http://www.fsc.go.jp/iken-bosyu/pc_nouyaku_methamidophos200306.html
※1 |
|
|
※2 |
催奇形性:胎児に奇形を起こす性質 |
|
※3 |
遺伝毒性:遺伝子やDNAに変化を与え、細胞や個体に悪影響をもたらす性質 |
|
|
|
| |
Ⅱ-Q67. |
ビスフェノールAのリスク評価が行われるとききましたが、どのような問題点があるのですか。(平成20年7月) |
|
Ⅱ-A67. |
ビスフェノールA※1については、動物の胎児や子どもが、従来の動物実験で有害な影響がないとされた量(5mg/kg体重)に比べて極めて低用量の曝露(2.4〜10μg/kg体重)を受けると、神経や行動、乳腺や前立腺に影響が認められたという報告があり、また、厚生労働省における最近の研究成果として、妊娠動物への投与により、これまでの報告よりさらに低い用量(0.5μg/kg体重)からその子どもに性周期異常等の遅発性影響がみられたとの報告がありました。
これらの実験は、ヒトの健康への影響を評価するための確立した実験評価手法で行われたものではなく、国際的にも議論があり、今後の調査研究の進展が必要ですが※2、影響を受けるかもしれない対象が胎児や乳幼児であることを踏まえ、食品安全委員会では厚生労働省からの依頼に基づき、その健康影響評価を行うことになりました。
なお、欧州食品安全機関(EFSA)は本年7月、人体はビスフェノールAを速やかに代謝し排出するため、母体の曝露による胎児への曝露は無視できるとの科学的意見を発表しています。
※1 |
ビスフェノールAは、ポリカーボネート樹脂、エポキシ樹脂などの原料として使用される化学物質で、耐容一日摂取量(これ以下の摂取量では一生涯毎日摂取しても有害な影響が現れない量)は0.05mg/kg体重/日に設定されています。
〈ポリカーボネート製品におけるビスフェノールAの規格基準〉
・材質試験基準(製品中に残留するビスフェノールAの量)500ppm以下
・溶出試験基準(製品の表面から溶出するビスフェノールAの量)2.5ppm以下 |
|
※2 |
米国食品医薬品局(FDA)は現在リスク評価を行っており、「ビスフェノールAの曝露量について、健康への影響を及ぼすレベルを下回っていることを裏付ける多くの証拠があるが、新しい研究や知見が入手できれば引き続き検討を行う」ことを表明しています。また、カナダ政府は予防的アプローチとして、ポリカーボネート製ほ乳瓶の輸入及び販売等を禁止しています。 |
|
(参考) |
|
|
|
|
| |
|
|
| |
Ⅱ-Q73. |
食品安全委員会で安全性の審査が行われている高濃度にジアシルグリセロール(DAG)を含む特定保健用食品の油や、含まれているグリシドール脂肪酸エステルについて、どのような問題があるのでしょうか。(平成21年9月) |
|
Ⅱ-A73. |
1.DAG油について
食用油の主要成分は、「グリセリン」に「脂肪酸」と総称される複数の炭素原子の鎖状構造が結合したものです。
一般的な食用油の主成分は、グリセリンに脂肪酸が3個結合しているトリグリセロールです。一方、グリセリンに脂肪酸が2個結合しているジアシルグリセロール(以下「DAG」とします。)は、脂肪が吸収されにくいため、体に脂肪が付きにくいとされ、このDAGを高濃度に含む油(以下「DAG油」とします。)を用いた製品に対し、平成10年5月に厚生労働省から特定保健用食品の表示許可が出されました。
DAGを高濃度に含むマヨネーズタイプの製品についても、平成15年に、「発がん性を示す所見は認められず、(発がん)促進作用を引き起こすとの報告もない」として特定保健用食品として認められました。
※ DAG油を用いた製品に対する特定保健用食品の表示許可については、その製品の製造事業者から平成21年10月8日付けで、失効届が提出されています。
この審議の過程で、フォルボールエステル(TPA)という化学物質とDAGとの比較が議論されました。TPAは、プロテインカイネースC(PKC)という酵素を活性化することにより、皮膚に対する発がん促進作用をもつことで知られています。DAGについては、PKCの活性化に関与することが判明していました。TPAがPKC活性化作用をもち、発がん促進作用をもつのであれば、DAGも同様の促進作用をもつのではないかと類推して、短期間で結果のわかる、より発がんしやすいラットを用いて、皮膚と類似の組織である口腔等に対する発がん促進作用の試験を行うこととされました。
この追加試験に基づく厚生労働省からの諮問を受け、食品安全委員会では、平成17年より、「高濃度にDAG を含む食品の安全性」について審議を行っています。
※ ここでいう発がん促進作用とは、それ自体が発がんを引き起こすものではありませんが、遺伝子に直接作用する発がん物質によって変異した細胞に働きかけてがんの発生を助ける作用のことをいいます。
2.グリシドール脂肪酸エステルについて
平成21年7月に、DAG油には、油脂を作る時の脱臭工程で生じるグリシドール脂肪酸エステルが、通常の食用油に比べて多く含まれることが判明しました。
グリシドール脂肪酸エステルについては、遺伝毒性を持つ発がん物質であるかどうかの毒性学的なデータは得られていませんが、消化されると分解されて、国際癌研究機関(IARC)により「人に対し発がん危険性あり」と分類されているグリシドールを遊離する可能性が否定できないとの指摘があります。また、体内に入った場合、どのように代謝され、どの程度が体内に吸収され、また排泄がどのように行われるのか、といったデータは得られていません。
このため、食品安全委員会では、「高濃度にDAG を含む食品の安全性」についての審議に加え、グリシドール脂肪酸エステルについても検討を行うため、追加資料を早急に提出するよう、平成21年9月に、厚生労働省へ要請したところですが、これまでのところ、グリシドール脂肪酸エステルが含まれるDAG
油を用いた各種試験等から得られた科学的知見からは、高濃度にDAG を含む食品に対して、緊急に対応しなければならないほどの毒性所見は得られていません。
食品安全委員会では科学的なデータに基づき中立公正に評価を行っています。追加資料が提出されましたら、これまでに得られている科学的知見と併せて、速やかに食品健康影響評価を取りまとめていくこととしています。
より詳しい情報をホームページに掲載しておりますので、ご覧ください。
「高濃度にジアシルグリセロール(DAG)を含む食用油等に関連する情報」
http://www.fsc.go.jp/sonota/diacylglycerol_dag5_qa_20091015.pdf
なお、これまでの検討の経過や内容については、すべて食品安全委員会のホームページで公表しています。
http://www.fsc.go.jp/senmon/sinkaihatu/index.html
|
|
|
| |
Ⅱ-Q76. |
マグロ等の魚には胎児に影響があるメチル水銀が含まれていると聞きましたが、妊婦が魚を食べても大丈夫ですか。(平成22年6月) |
|
Ⅱ-A76. |
魚介類の体内には自然界の食物連鎖を通じて微量のメチル水銀が蓄積されています。その含有量は一般に低いので健康に害を及ぼすものではありませんが、クジラやマグロ等の一部の魚介類については、食物連鎖を通じた濃縮を経てメチル水銀濃度が比較的高いものも見受けられます。
メチル水銀は、体内に入った後、消化管から血中へと吸収され、肝臓や腎臓を経由して糞尿として排泄されるほか、毛髪にも含まれて体外に出されます。妊婦の場合は、体内に入ったメチル水銀の一部が胎盤を通過して胎児に移り、その胎児の機能的発育に影響を及ぼす可能性があります。
食品安全委員会では、平成17年8月に「魚介類等に含まれるメチル水銀についての食品健康影響評価」をとりまとめました。その中で、胎児をハイリスクグループとし、妊婦が1週間に摂取しても胎児に影響を及ぼさない量(耐容週間摂取量)を、妊婦の体重1kg当たり水銀として2.0μgとしました。
食品安全委員会のホームページでは、メチル水銀の摂取量を耐容週間摂取量以下に抑えた1週間の魚料理の献立の例も紹介していますので、是非参考にしてください。
魚介類は、良質なタンパク質や、生活習慣病の予防、脳の発育に効果があると言われているEPA、DHA等の不飽和脂肪酸を多く含み、また、カルシウムを始めとする各種の微量栄養素の摂取源として健康的な食生活に不可欠な食品です。メチル水銀濃度が高い魚ばかりを多量に食べることを避け、魚食のメリットを活かしましょう。
|
|
|
|
|
Ⅱ-Q78. |
ベーキングパウダーなどの膨張剤にはアルミニウムが含まれているものがあるそうですが、食品安全委員会において、アルミニウムについてこれまでに分かっていることを教えてください。(平成22年10月) |
|
Ⅱ-A78. |
食品安全委員会では、リスク管理機関から諮問を受けて行うリスク評価のほか、対象案件を自ら選定して行う評価(自ら評価)も行っています。アルミニウムについては、平成22年3月に自ら評価の対象案件として選定しており、リスク評価を行うために必要な情報の収集を行っているところです。
アルミニウムは、土壌、水及び空気中に存在し、包装材料などに幅広く使用されています。国内での規制としては、水道法に基づく水道水質基準として、アルミニウム及びその化合物の量を0.2mg/ℓ(アルミニウムとして)以下としているほか、食品添加物としても、硫酸アルミニウムアンモニウムなどについて食品衛生法に基づく規格基準が設定されています。
国際的には、平成18年にFAO/WHO合同食品添加物専門家会議(JECFA)第67回会合において、アルミニウムについて、従来より低い投与量でも繁殖や発達神経に関する健康影響がある可能性があるため、耐容週間摂取量(TWI)の暫定的な値を7mg/kg体重/週から1mg/kg体重/週に引き下げています。今後、各国が行っている追加試験のデータを基に、再度JECFAにおいて安全性評価が行われる予定です。
なお、TWIとは人が一生涯摂取し続けても健康への悪影響がないと推定される一週間あたりの摂取量のことであり、この値を超える物質を摂取しても直ちに健康への悪影響があるわけではありません。
また、アルミニウムがアルツハイマー病の原因ではないかという説もありましたが、現時点では、アルミニウムとアルツハイマー病の関連性についての明確な科学的な根拠はないとされています。
|
|
|
|
|
Ⅱ-Q79. |
LDLコレステロールの数値が高く、トランス脂肪酸が心配なのですが、トランス脂肪酸の概要を教えてください。(平成22年12月) |
|
Ⅱ-A79. |
トランス脂肪酸は、トランス型の二重結合を持つ不飽和脂肪酸です。天然では反すう動物の肉や乳に少量含まれ、工業的なものではマーガリンやショートニングなどの加工油脂とこれらを使用して作られる食品などに含まれています。
その作用としては、いわゆる悪玉コレステロール(LDLコレステロール)を増加させ、善玉コレステロール(HDLコレステロール)を減少させる働きがあるといわれています。また、動脈硬化などによる虚血性心疾患のリスクを高めるという報告もあります。
日本人の一般的な食生活の中ではトランス脂肪酸の摂取量は少ないと考えられますが、脂肪の多い菓子類をよく食べるなど偏った食事をしている場合は、平均を大きく上回る摂取量となる可能性があるため、注意が必要です。
食品安全委員会では、その時点で知られているトランス脂肪酸に関する信頼性のある情報をわかりやすくまとめて国民に情報提供するため、平成16年12月にファクトシート(科学的知見に基づく概要書)を作成し、必要に応じて更新しており、平成22年12月には、国際機関におけるリスクに関する科学的知見や諸外国における対応、国内の動きなど、新たな情報が蓄積されたことから、ファクトシートを更新しました。
また、平成22年3月に自ら評価の案件としてトランス脂肪酸を選定し、同年4月から新開発食品専門調査会において現時点での国内外の最新の知見に基づいたリスク評価を行っており、評価結果が取りまとめられた際には、更に情報提供を行っていきます。
なお、トランス脂肪酸のみならず、脂肪のとりすぎ、飽和脂肪酸や食事性コレステロールの多量の摂取も心疾患のリスクを高めるため、日頃から脂肪の摂取について注意し、動物、植物、魚由来の脂肪をバランスよくとることが大切です。
|
|
|
|
|
Ⅱ-Q81. |
トランス脂肪酸の食品健康影響評価が行われたと聞きました。概要を教えてください。(平成24年2月) |
|
Ⅱ-A81. |
トランス脂肪酸は、脂質の構成成分である脂肪酸の一種です。大きく分けて、工業的に加工した植物油等に由来するものと、牛などの反すう動物に由来し乳製品・肉に含まれるものがあります。
食品安全委員会では、食生活の変化により若年層の摂取量が増えていると考えられたことから、2010年3月に自ら食品健康影響評価を行うことを決定し、2012年3月に評価書を取りまとめました。
その評価書の概要は以下の通りです。
諸外国における研究結果によれば、トランス脂肪酸の過剰摂取は、冠動脈疾患を増加させる可能性が高いとされています。また、肥満やアレルギー疾患についても、関連が認められたものがあります。さらに、妊産婦・胎児への影響についても、関連が報告されています。
しかし、こうした研究結果は、トランス脂肪酸の摂取量が、平均的な日本人よりも相当多いケースの結果であり、平均的な日本人の摂取量においては、これらの疾患リスクとの関連があるかは明らかではありません。
世界保健機関(WHO)では、心血管系疾患のリスクを低減し、健康を増進するための目標(※)として、トランス脂肪酸の摂取量を総エネルギー量の1%未満に抑えるよう提示しています。
(※)WHOの原文では「recommendation」。評価書では「勧告(目標)基準」と記載。
日本人の大多数は、WHOの目標を下回っており、通常の食生活では、健康への影響は小さいと考えられますが、脂質に偏った食事をしている人は、留意する必要があります。
トランス脂肪酸は、ヒトに不可欠なものではなく、できるだけ摂取を少なくすることが望まれますが、脂質自体は重要な栄養素であり、極端な制限は健康に悪影響を与えます。バランスの良い食事を心がけることが大切です。
食品事業者においては、食品中のトランス脂肪酸含有量は近年減少傾向にありますが、一部製品は高いものがみられることから、引き続きその低減に努める必要があります。
リスク管理機関(厚生労働省等)においては、今後とも日本人のトランス脂肪酸の摂取量について注視し、知見の収集や適切な情報提供が必要です。
|
|
|
| iii |
生物系(微生物、ウイルス、プリオン、自然毒等) |
|
| |
Ⅱ-Q13. |
「にがり」が体に良いと言われる一方、「にがり」という形でミネラルを摂取するのは問題があるという情報もあります。「にがり」のリスク等について教えて下さい。(平成16年1月) |
|
Ⅱ-A13. |
海水から食塩、塩化カリウムを取り出し、分離した残りが「にがり」であり、古くから我が国の食生活に用いられています。「にがり」の主成分は塩化マグネシウムであることが知られています。
マグネシウムは、重要な生理作用を有する栄養素で、人体に必要不可欠なもので、一般的に毒性の高いものではありません。しかしながら、乳幼児〜小児のマグネシウム摂取は一般的に充足しているので、マグネシウムの摂取が特段必要な状況ではありません。マグネシウムを大量に摂取すると下痢等の消化器症状が起きる可能性等もありますので、乳幼児〜小児以外の方々であっても、不必要に過剰な摂取は望ましいものではありません。
いずれにしても、日常の食生活全体の栄養のバランスに配慮し摂取することが大切と考えられます。 |
|
|
| |
Ⅱ-Q16. |
と畜場における疾病にり患した家畜の肉等の廃棄基準についてのリスク評価結果を分かりやすく教えて下さい。(平成16年5月) |
|
Ⅱ-A16. |
食品衛生法の改正に伴い、と畜場における疾病にり患した家畜の肉等の廃棄基準を見直す必要が生じたことから、昨年10月、厚生労働省から当委員会に対して食品健康影響に関する意見が求められ、審議を行いました。
今回、意見要請のあった疾病にり患した家畜について、ヒトへの病原性が指摘されている疾病は、「とさつ・解体禁止、全部廃棄」、それ以外の疾病についても現時点において、ヒトへの病原性に関する科学的データが乏しくヒトへの病原性がないと判断することはできないことから「とさつ・解体禁止、全部廃棄」とする考え方が妥当であると評価したものです。
|
|
|
| |
Ⅱ-Q19. |
シンフィツム(いわゆるコンフリー)及びこれを含む食品に係る評価についてわかりやすく説明してください。(平成16年6月) |
|
Ⅱ-A19. |
厚生労働省から意見を求められた「シンフィツム(いわゆるコンフリー)及びこれを含む食品」に係る食品健康影響評価については、6月14日に開催された第2回かび毒・自然毒等専門調査会において評価結果を取りまとめ、6月17日に開催された食品安全委員会第49回会合において審議し、食品健康影響評価の結果を取りまとめ、同日付で厚生労働大臣に通知しました。
本件に係る食品健康影響の審議結果の概要は次のとおりです。
|
(1) |
コンフリーの葉や、それを原料に含む健康食品を摂取することなどによるシンフィツム(いわゆるコンフリー)が原因と考えられるヒトの肝静脈閉塞性疾患等の健康被害例が海外において多数報告されています(死亡例も含まれます)。また、コンフリーのヒトに対する健康影響は、それに含まれるピロリジジンアルカロイドの作用によると考えられており、それによる中毒や健康被害例の報告も多く、特に幼児については、より感受性が高いとの報告もなされています。 |
|
|
(2) |
一方で、コンフリーそのものの各種毒性試験が十分に実施されていないなど、コンフリーを食することによるリスクの程度を定量的(どのくらいの量を食べると健康被害を生ずるかなど)に評価するための情報が、現時点においては不十分と判断されます。 |
|
|
(3) |
日本においては、これまでにコンフリーによる肝障害の事例は報告されていませんが、コンフリーを使用した健康食品等がインターネットを使って販売されていることが確認されており、これらの健康食品等を摂取することによって健康被害が生じるおそれがあると考えられます。また、日本においてコンフリーが家庭菜園等で栽培されているとの情報もあり、栽培又は自生しているコンフリーを摂食することによる健康被害が生じる可能性も否定できないことから、広く国民一般に対し、コンフリーを摂食することのリスクについて注意喚起するなど適切なリスク管理措置を講じるべきであると考えられます。 |
|
|
(4) |
さらに、コンフリー以外のピロリジジンアルカロイドを含む食品については、日本において一般的に大量又は長期的に摂取する実態はないものと考えられ、これらの食品を摂取することによるリスクはコンフリーに比べて低いと推測されますが、引き続き摂取実態及びピロリジジンアルカロイド含量等の関連情報の収集に努め、それらによって得られた知見に基づき適宜食品健康影響評価を行っていくことが適切であると考えられます。 |
なお、厚生労働省においては、食品健康影響評価の結果の通知を踏まえ、6月18日に地方自治体、関係業者等に対して、コンフリー及びこれを含む食品については食品衛生法第6条第2号に該当するものと判断され、販売等の禁止の対策が講じられました。
詳細については厚生労働省のホームページ
( http://www.mhlw.go.jp/topics/2004/06/tp0614-2.html)をご参照ください。
(参考)
1.シンフィツム(いわゆるコンフリー、学名:Symphytum spp.)
ヒレハリソウともいいます。ムラサキ科ヒレハリソウ属の多年生草本で、コーカサスを原産地とし、ヨーロッパから西アジアに分布します。草丈は60〜90cmで、直立し、全身に粗毛が生え、葉は卵形から長卵形。初夏から夏にかけて花茎を伸ばして釣鐘上の白〜薄紫色の花を咲かせます。
今回、厚生労働省から評価を求められたコンフリーは、コンフリー属(Symphytum spp.)全般であり、主な種として、通常のコンフリー(S.
offcinale)、プリックリーコンフリー(S. asperum)、ロシアンコンフリー(S. x uplandicum)などがあります。
2.海外では、次のような対策が講じられています。
カナダ:
コンフリーを含む食品は原則としてその販売が禁止されています。消費者に対して、コンフリー又はこれを含む食品を使用しないように勧告しています。
豪州・ニュージーランド:
コンフリー等に含まれるピロリジジンアルカロイドについて暫定的耐容摂取量(1μg/kgbw./day)を設定するとともに、コンフリーを食用に添加することや食用に供することを禁止しています。
米 国:
米国食品医薬品局(FDA)から関係業界に対し、コンフリー等を含む栄養補助食品の自主回収等を勧告しています。
ドイツ:
ハーブサプリメントからのピロリジジンアルカロイド及びN-オキシド体の最大許容摂取量を0.1μg/日と定め、1年間に6週間までであれば、1日1μgまでの摂取は許容されるとしています。
|
|
|
| |
Ⅱ-Q21. |
ジャガイモに含まれるソラニンの中毒の発現量について教えてください。(平成16年7月) |
|
Ⅱ-A21. |
ソラニンはジャガイモの発芽部や緑色部分に含まれる有毒な物質(ステロイド系アルカイド配糖体、C45H73NO15)として古くから知られているものです。
典型的な中毒症状としては、食後数時間後に発症し、腹痛、胃腸障害、虚脱、めまい、ねむけ、軽度の意識障害があります。
ソラニンの中毒の発現量に関してですが、文献(注1)によれば、ヒトの中毒量は25mg、致死量は400mgとの指摘があります(ウサギの経口試験によるLD50(半数致死量)(注2)は、450mg/体重kg)。
(注1)「食中毒(細貝祐太朗、松本昌雄監修)中央法規」による。
(注2)LD50は化学物質の急性毒性の指標で、実験動物集団に経口投与等により投与した場合に、一定日数以内にその実験動物集団の50%が死に至る量をいいます。 |
|
|
| |
Ⅱ-Q27. |
ウコンの安全性について教えてください。(平成16年10月) |
|
Ⅱ-A27. |
ウコンは、ショウガ科の植物で、ターメリックとも呼ばれ、カレー粉の原料や色素、また、古くから漢方薬として用いられています。
ウコン粉末摂取と肝障害発症の関連を疑わせるマスコミ報道がありましたが、現時点においてウコン粉末と肝障害の因果関係は不明です。
いずれにしても、過剰な摂取をさけ、日常の食生活全体の栄養のバランスに配慮しながら摂取することが大切と考えられます。 |
|
|
| |
Ⅱ-Q29. |
鶏肉に付着した菌を殺菌するために有効な加熱温度を教えてください。(平成16年11月) |
|
Ⅱ-A29. |
鶏肉の場合、主にカンピロバクター、サルモネラ属菌の汚染が考えられます。一般的に食品の中心部を75℃で1分以上加熱すれば、家庭内の食中毒を防げます。 |
|
|
| |
Ⅱ-Q38. |
食中毒原因微生物のリスク評価については、食品安全委員会が自らの判断により評価することを決定したと聞きましたが、決定までの経緯と今後の審議について教えてください。(平成17年6月) |
|
Ⅱ-A38. |
食品安全委員会は、厚生労働省、農林水産省及び環境省からの要請によりリスク評価を行うほか、自らの判断によってもリスク評価を行います。このため、その対象について、関係機関やマスメディア等から収集した情報や国民の皆様からの情報等を踏まえ、企画専門調査会及び委員会において定期的に点検・検討することとしています。
食中毒原因微生物のリスク評価については、平成16年12月の食品安全委員会において、食中毒により毎年数万人の患者が発生し数名の死者が出ていることから、正確な情報を国民の皆様へ提供することが重要であると考え、企画専門調査会が選定した候補の中から食品安全委員会が自らの判断により行うリスク評価案件として決定しました。
これを受けて、微生物・ウイルス合同専門調査会において、食中毒原因微生物のリスク評価指針を策定し、食中毒原因微生物について優先順位を決めて、リスク評価を行うこととしています。 |
|
|
| |
Ⅱ-Q54. |
ノロウイルスの感染が広く報じられていますが、食中毒の予防法を教えてください。(平成18年12月) |
|
Ⅱ-A54. |
ノロウイルスによる食中毒は、夏の食中毒の原因となりやすいカンピロバクターやサルモネラといった細菌とは異なり、冬場に多く発生するのが特徴です。二枚貝の生食や調理従事者からの二次感染による様々な食品が原因となり、人から人への二次感染もあります。
少量のウイルスでも発症し、感染すると24〜48時間の潜伏期を経た後、下痢、嘔吐、吐き気、腹痛、38℃以下の発熱などの症状が現れます。特にこどもや高齢者は感染した場合、健康な成人よりも重篤化しやすいので注意が必要です。ノロウイルスについてはワクチンがなく、治療は対症療法に限られます。
ノロウイルスによる食中毒を防ぐためには、以下のような取組が有効です。
|
(1) |
加熱が必要な食品は中心部まで充分に加熱する。(ノロウイルスは、85℃・1分以上で不活化されます。) |
|
|
(2) |
野菜などの生鮮食品は充分に洗浄する。 |
|
|
(3) |
手指をよく洗浄する。 |
|
|
(4) |
感染者の便、嘔吐物に直接接触しない。 |
|
|
(5) |
器具や床の消毒には高濃度の次亜塩素酸ナトリウム※を用いる。(逆性石鹸やエタノールはあまり効果がない)
※塩素系の漂白剤としても使用されています。(使用に当たっては「使用上の注意」を確認しましょう。) |
上記の他、以下に示す一般的な対策としての「食中毒予防の6つのポイント」を確実に実行することが大切です。
|
ポイント1 |
「食品の購入」 新鮮な物、消費期限を確認して購入する等 |
|
|
ポイント2 |
「家庭での保存」 持ち帰ったらすぐに冷蔵庫や冷凍庫で保存する等 |
|
|
ポイント3 |
「下準備」 手を洗う、きれいな調理器具を使う等 |
|
|
ポイント4 |
「調理」 手を洗う、充分に加熱する等 |
|
|
ポイント5 |
「食事」 手を洗う、室温に長く放置しない等 |
|
|
ポイント6 |
「残った食品」 きれいな器具容器で保存する、再加熱する等 |
|
|
|
|
| |
|
|
| |
Ⅱ-Q63. |
フグの食中毒について教えてください。(平成20年1月)
|
|
Ⅱ-A63. |
フグによる食中毒はフグの体内に含まれるテトロドトキシンが主な原因です。
テトロドトキシンは強力な神経毒で、食後30分から主に末梢神経を侵し、全身の運動神経や知覚神経の麻痺などを起こします。毒力は青酸ナトリウムの約1,000倍といわれており、他の自然毒(毒きのこ等)に比べて死亡率が高く、日本においてほぼ毎年死者が出ています。また、耐熱性も高いことがわかっています。
フグは、厚生労働省の通知により、種類及び漁獲海域によって「食べられる部位」が決まっており、肝臓、卵巣、腸はすべての種類で食べられません。また、フグの処理は、有毒部位の確実な除去等ができると都道府県知事等が認める者及び施設に限られています。一般の方がフグを調理し喫食することは極めて危険であり、最悪の場合は死亡するおそれがあることから、絶対に行わないでください。
なお、食品安全委員会は、厚生労働省より意見を求められた、特定の方法により養殖されるトラフグの肝の可食化に関する安全性について、かび毒・自然毒等専門調査会で審議し、「現在までの知見において、テトロドトキシンによるトラフグの毒化機構は十分に明らかとは言えない」などの理由により、現時点において、食品としての安全性が確保されていることを確認することはできない旨、平成17年8月5日に、厚生労働省に食品健康影響評価の結果を通知しました。
http://www.fsc.go.jp/hyouka/hy/hy-tuuchi-torafugu170805.pdf
|
|
|
|
| |
Ⅱ−Q66. |
これから夏場にかけて流行する食中毒にはどのようなものがありますか。また、食中毒を予防するにはどのような注意が必要なのでしょうか。(平成20年5月) |
|
Ⅱ−A66. |
夏場に流行する代表的な食中毒としては、腸炎ビブリオ、カンピロバクター及びサルモネラなどの細菌によるものがあげられます。いずれも一般的に、腹痛、発熱、下痢、おう吐などの症状を引き起こします。
食中毒を予防するには、以下の6つのポイントに気をつけて保存や調理などを行うことが大切です。
1、食品は新鮮な物を選び、消費期限を確認して購入すること
2、持ち帰ったらすぐに冷蔵庫や冷凍庫で保存すること
3、食品を取り扱う前だけでなく調理中も頻繁に手洗いを行うこと
4、調理するときは中心まで十分に加熱すること
5、調理済みの食品を室温に長く放置しないこと
6、残った食品はきれいな器具容器で保存すること
なお、食品安全委員会のホームページでは食中毒の予防に役立つ詳しい情報をお知らせていますので、併せてご覧ください。
(参考)
食品安全委員会ホームページ「食中毒について」
http://www.fsc.go.jp/sonota/shokutyudoku.html |
|
|
|
| |
Ⅱ−Q72. |
この度食品安全委員会では、カンピロバクターの自ら評価を行ったと聞きましたが、安全性の評価はどのように行われたのでしょうか。評価結果についておしえてください。(平成21年6月) -NEW- |
|
Ⅱ−A72. |
今回の評価では、食中毒の上位を占めている原因物質であるカンピロバクターについて、
・ 鶏肉を食べることにより起こるカンピロバクター食中毒のリスク
・ カンピロバクター食中毒対策として想定した6種類の対策を講じた場合のリスクの低減効果
を調べました。
その結果、 |
・ |
鶏肉を生で食べる人は食べない人よりリスクが高い |
という現状にあり、 |
|
リスク低減効果の高い対策としては、 |
・ |
食鳥処理場においてカンピロバクターに汚染された鶏と汚染されていない鶏を分けて処理すること、 |
・ |
鶏肉の生食割合の低減についての啓発に努めること、 |
・ |
各対策を組み合わせて行うとリスクの低減効果が高いため施策を実施するにあたってはフードチェーン全般にわたる関係者間で連携を図ること、 |
が大切という結果となりました。 |
|
なお、平成21年6月25日に厚生労働省と農林水産省へ、適切な管理を検討されるよう、評価結果を通知しています。
詳しくは、食品安全委員会ホームページに掲載されていますのでご覧下さい。
・ 鶏肉中のカンピロバクター・ジェジュニ/コリの食品健康影響評価結果
http://www.fsc.go.jp/hyouka/hy/hy-tuuchi-campylobacter_k_n.pdf
・ 鶏肉中のカンピロバクター・ジェジュニ/コリに関する意見交換会開催結果
http://www.fsc.go.jp/koukan/risk-campylo210603_0605/risk-campylo210603_0605.html
をご覧下さい。 |
|
|
|
| |
|
|
| |
|
|
|
| iv |
新食品等(遺伝子組換え食品、新開発食品等) |
|
| |
Ⅱ-Q3. |
アマメシバは、生で食べれば安全と聞いたのですが、本当なのですか。(平成15年8月) |
|
Ⅱ-A3. |
9月4日に、食品安全委員会では、厚生労働省の要請により、「サウロパス・アンドロジナス(いわゆるアマメシバ)を大量長期に摂取することが可能な粉末、錠剤等の形態の加工食品」について健康影響評価を行い、「アマメシバ粉末(これを錠剤にしたものを含む)の長期摂取と閉塞性細気管支炎との因果関係は否定できない」と回答したところですが、これは、生鮮アマメシバについて健康影響評価を行ったものではありません。
一方、厚生労働省の9月5日の記者発表によれば、「生鮮食品としてのアマメシバを通常の方法で摂取することについては今のところ問題がないと考えている」と発表しています。
(参考)
(1) |
マレーシアなど伝統的に調理したものを食用としてきた地域での被害例は報告されていない。 |
|
(2) |
台湾では、生鮮アマメシバをそのまま絞ってジュースとして大量に飲用することで健康被害が発生したと報告されている。 |
|
|
|
| |
Ⅱ-Q7. |
遺伝子組換え食品に関する意見募集がありましたが、その趣旨について教えてください。(平成15年10月) |
|
Ⅱ-A7. |
10月3日に開催された遺伝子組換え食品等専門調査会において、遺伝子組換え食品等の評価基準の作成方法について検討されましたが、専門調査会より選出された4名の起草委員が、まず評価基準案を作成し、その案に基づき、次回調査会で詳細な検討を行っていくこととされたところです。
また、この評価基準案を作成するに当たって、事前に、広く一般の方からのご意見を求め、基準案作成の参考とすることを趣旨として、食品安全委員会として、10月6日から21日まで「遺伝子組換え食品等の評価基準策定に係る意見募集」を行いました。
さらに、10月24日には、リスクコミュニケーションの一環として、「遺伝子組換え食品についてご意見を聴く会」を開催し、公募された一般の方を含め、10名の研究者、開発者、消費者団体の方等から、遺伝子組換え食品等に関して広く意見を伺いました。
いただいたご意見等のうち、評価基準作成に係るご意見については、今後の遺伝子組換え食品等専門調査会での評価基準案の作成・検討に参考にさせていただく予定としております。 |
|
|
| |
Ⅱ-Q42. |
大豆イソフラボンの食品健康影響評価について審議中ですが、審議の状況及びポイントについて教えてください。(平成17年10月) |
|
Ⅱ-A42. |
大豆イソフラボンアグリコン等を含む食品については、平成16年1月及び5月に、厚生労働大臣から特定保健用食品の許可申請に係る食品健康影響評価の要請があり、食品安全委員会新開発食品等専門調査会で審議を行っているところです。
平成17年4月28日の食品安全委員会において、大豆イソフラボンアグリコン等を含む食品3品目に係る専門調査会での審議結果が報告され、国民からの意見・情報の募集が行なわれました。その結果、様々な立場から数多くの意見が寄せられたことから、6月14日の第24回新開発食品等専門調査会において評価書案の修正について検討を行い、更に、7月8日の同専門調査会において、厚生労働省から大豆イソフラボンの摂取量について新たな疫学データ等の提出があったことから、引き続き十分な審議と評価書案の精査が必要とされ、現在、特に大豆イソフラボンが有するエストロジェン様作用の評価を中心に検討が進められているところです。 |
|
|
| |
Ⅱ-Q43. |
大豆イソフラボンを摂りすぎるとホルモンのバランスを崩すおそれがあるなどと報道されていますが、大豆食品の摂取は控えたほうが良いのでしょうか。(平成18年2月) |
|
Ⅱ-A43. |
今回の大豆イソフラボンを含む特定保健用食品(3品目)の食品健康影響評価(案)は、これまで長い食経験を有する大豆あるいは大豆由来食品そのものの安全性を問題としているのではなく、通常の食事で大豆由来食品を摂取されていることを前提に、追加的に大豆イソフラボンを含む特定保健用食品を摂取する場合の安全性を評価したものです。
食品安全委員会新開発食品専門調査会では、「大豆イソフラボンを含む特定保健用食品の安全性評価の基本的な考え方(案)」において、大豆イソフラボンの一日摂取目安量の上限を大豆イソフラボンアグリコンとして70〜75mg/日としています。一方、特定保健用食品としての大豆イソフラボンアグリコンの一日上乗せ摂取量については、おおよそ30mg/日としています。なお、従来から長い食経験を有する大豆由来食品からの摂取量が、大豆イソフラボンアグリコンの一日摂取目安量の上限値を超えることにより、直ちに健康被害に結びつくものではありません。
また、健康のためには、特定の成分のみを摂取することよりも、バランスの良い食事を摂ることが重要です。大豆は、大豆イソフラボンを含むこと以外にも、低脂肪で良質なたんぱく質源であり、また、日本人に不足しがちなカルシウムの供給源としても有用な食品ですので、大豆イソフラボンのみをサプリメントとして摂取するよりも、大豆由来食品を摂取した方が理想的な食生活に近づきます。平成17年6月に厚生労働省と農林水産省が決定・公表した「食事バランスガイド」等を参考に、ひとつの食品・成分に偏ることなく、バランスの良い食生活を心がけていただきたいと思います。
詳細につきましては、食品安全委員会ホームページの
「大豆イソフラボンを含む特定保健用食品の安全性評価の基本的な考え方(案)」
( http://www.fsc.go.jp/iken-bosyu/pc_isoflavone180309_4.pdf)、
「大豆イソフラボンを含む特定保健用食品(3品目)の食品健康影響評価(案)のポイントについて」
( http://www.fsc.go.jp/hyouka/isoflavone/hy_isoflavone_hyouka_point.pdf)
及び「大豆及び大豆イソフラボンに関するQ&A」
( http://www.fsc.go.jp/sonota/daizu_isoflavone.html)をご参照ください。 |
|
|
| |
Ⅱ-Q44. |
アガリクスを含む製品について、厚生労働省から食品健康影響評価を依頼されましたが、今後どのように審議を進めていくのですか。(平成18年3月) |
|
Ⅱ-A44. |
アガリクスを含む食品のうち、「キリン細胞壁破砕アガリクス顆粒」については、国立医薬品食品衛生研究所より、ラットを用いた中期多臓器発がん試験の結果、発がんを促進する作用が認められたとの中間報告があったことから、食品衛生法に基づき、本製品の販売を禁止するため、平成18年2月13日付けで厚生労働大臣から食品安全委員会に対し、食品健康影響評価の要請がありました。
本製品については、同年2月16日の食品安全委員会において、新開発食品専門調査会を中心に他の専門調査会の協力を得て審議することとされました。
これを受けて、新開発食品専門調査会の専門委員を中心とし、今回の審議内容を専門とする他の専門調査会に属する専門委員の参加を得て、3月15日付けで新開発食品専門調査会の下に11名からなるワーキンググループを設置したところです。今後、ワーキンググループでの検討状況は、適宜、新開発食品専門調査会に報告されるとともに、その評価結果は、新開発食品専門調査会の了解を得て、同専門調査会の評価結果とすることとしています。
また、同年2月13日付けでその安全性について食品健康影響評価の依頼があった「仙生露顆粒ゴールド」及び「アガリクスK 2ABPC顆粒」のアガリクスを含む2製品については、国立医薬品食品衛生研究所において、遺伝毒性試験及び中期多臓器発がん試験を実施しており、その具体的な試験結果については、今後、厚生労働省から報告されることとなっています。
詳細につきましては、食品安全委員会ホームページの第34回新開発食品専門調査会
「資料2 アガリクスを含む製品の食品健康影響評価の進め方について(案)」
( http://www.fsc.go.jp/fsciis/meetingMaterial/show/kai20060315sh1)をご覧ください。 |
|
|
| |
Ⅱ-Q45. |
大豆イソフラボンを含む特定保健用食品(3品目)の食品健康影響評価について、なぜ大豆イソフラボンアグリコンに換算して評価しているのですか。大豆イソフラボンアグリコンへの換算方法についても教えてください。(平成18年3月) |
|
Ⅱ-A45. |
大豆や大豆食品中に含まれる大豆イソフラボンは、主に配糖体として存在していますが、糖の部分が分離したものをアグリコンといい、味噌、納豆等の伝統的な大豆発酵食品中に含まれます。また、ヒトが摂取した大豆イソフラボン配糖体は、腸内細菌の作用等により、大豆イソフラボンアグリコンとなり、腸管から吸収されます。
このため、大豆イソフラボン配糖体を含む特定保健用食品についても大豆イソフラボンアグリコンに換算することにより、安全性評価を検討することが適切であるとしました。
大豆イソフラボン配糖体から、大豆イソフラボンアグリコンに換算する場合、配糖体とアグリコンとの分子量の比から求めることができます。個々の食品に含まれる3種類の大豆イソフラボンアグリコン(ゲニステイン、ダイゼイン、グリシテイン)の量は分析しなければわからないため、原則として、3種類のアグリコン中一番エストロゲン活性の高いゲニステインの換算値(約0.625)を用いて換算しております。
(例)大豆イソフラボン配糖体10mg×0.625 =大豆イソフラボンアグリコンとして6.25mg
詳細につきましては、食品安全委員会ホームページの
「大豆イソフラボンを含む特定保健用食品の安全性評価の基本的な考え方(案)」
( http://www.fsc.go.jp/iken-bosyu/pc_isoflavone180309_4.pdf)
「大豆イソフラボンを含む特定保健用食品(3品目)の食品健康影響評価(案)のポイントについて」
( http://www.fsc.go.jp/hyouka/isoflavone/hy_isoflavone_hyouka_point.pdf)
及び「大豆及び大豆イソフラボンに関するQ&A」( http://www.fsc.go.jp/sonota/daizu_isoflavone.html)をご参照ください。 |
|
|
| |
Ⅱ-Q50. |
サプリメントとして流通しているコエンザイムQ10の一日推奨量は、医薬品よりも多くなっているものがほとんどであると新聞で読み、不安になった。コエンザイムQ10の安全性について教えてほしい。(平成18年9月)
|
|
Ⅱ-A50. |
食品安全委員会では、平成17年8月に厚生労働省から、「コエンザイムQ10」の安全性に係る食品健康影響評価について意見を求められ、調査審議を重ねてきました。
コエンザイムQ10は、ユビキノン又はユビデカレノンともよばれ、動物や植物の体内で合成される脂溶性の物質であり、ヒトの体内でも合成されます。
わが国において、コエンザイムQ10は、心臓疾患の医療用医薬品として、1日30mgの用量で認められている一方で、「いわゆる健康食品」として、1日推奨量30〜300mgの製品が流通しています。また、米国においては、サプリメントとして1日推奨量100〜1200mgの製品が流通しています。
|
食品安全委員会で審議を行った結果、 |
|
|
(1) |
コエンザイムQ10の摂取上限目安量が判断できる長期摂取試験の不足 |
|
|
(2) |
コエンザイムQ10の生体内の合成・代謝系等に与える影響を判断できる情報の不足 |
|
|
(3) |
コエンザイムQ10の製品別の体内吸収性の差 |
|
|
(4) |
健康被害事例の明確性 |
についての問題点が指摘され、平成18年8月10日、「コエンザイムQ10の安全性について、厚生労働省から提出された資料ではデータが不足しており、安全な摂取上限量を決めることは困難である」と結論しました。
( http://www.fsc.go.jp/hyouka/hy/hy-tuuchi-180810-coq10.pdf)
評価は困難でしたが、リスク管理機関である厚生労働省に対して、リスク管理措置を講じる際には、これまでどおり、原則医薬品の一日用量を超えないというリスク管理のもとで、事業者の責任で、用量を考慮した長期摂取での安全性の確認、摂取上の注意事項の消費者への提供、消費者の健康被害事例を収集させるなどの指導を徹底することについても考慮すべきとしました。
これを受けて、厚生労働省では自治体を通じて事業者への指導を行っています。
また、コエンザイムQ10を含め「いわゆる健康食品」に関する安全性・有効性情報が、(独)国立健康・栄養研究所のホームページ( http://hfnet.nih.go.jp/)に掲載されておりますので、参考にして下さい。 |
|
|
| |
Ⅱ-Q53. |
遺伝子組換え食品は本当に安全でしょうか。食品安全委員会における評価ポイントを教えてください。(平成18年11月)
|
|
Ⅱ-A53. |
遺伝子組換えとは、ある生物から取り出した有用な遺伝子を他の食用となる植物などに組み込むことをいい、この「遺伝子組換え技術」を用いてつくられた食品のことを「遺伝子組換え食品」といいます。
遺伝子組換え食品については、品目ごとに安全性の審査を受けることが法律(食品衛生法)で定められており、その安全性の評価については、食品安全委員会が行っています。
遺伝子組換え食品の安全性については、主に、遺伝子組換えによって新たに付け加えられた全ての性質と、遺伝子組換えによって、他の悪影響が生じる可能性がないかという点について、これまでに食べられてきた食品(非遺伝子組換え食品)と比較し、評価を行っております。
例えば、遺伝子組換えとうもろこしの安全性評価を行う場合は、遺伝子組換えではない、従来品種のとうもろこしと同じように食しても問題がないかについて、食品安全委員会が策定した安全性評価基準に基づき、様々な観点から、安全性を確認しております。
具体的な安全性評価のポイントは、
・組み込まれた遺伝子は安全か
・組み込まれた遺伝子が作り出すたんぱく質に有害性はないか
・組み込まれた遺伝子が作り出すたんぱく質にアレルギーを誘発する可能性はないか
・組み込まれた遺伝子が間接的に作用し、他の有害物質を作る可能性はないか
・栄養素、栄養阻害物質などの構成成分や量が大きく変化していないか
などです。
これらについて、科学的なデータを基に総合的に判断されます。
安全性評価のための科学的なデータは、遺伝子組換え食品を開発した会社等の申請者から提出されますが、安全性について疑問が残る場合には、追加のデータを求め、審議を行っております。
より詳しくは、食品安全委員会ホームページに安全性評価基準を掲載しておりますのでご覧ください。( http://www.fsc.go.jp/senmon/idensi/index.html
)
食品安全委員会の季刊誌「食品安全vol.5」でも『遺伝子組換え食品のリスク評価を理解する』という特集を組んでおりますので、ご参考になさってください。
( http://www.fsc.go.jp/sonota/5gou_2.pdf
) |
|
|
| |
|
|
| |
Ⅱ−Q71. |
遺伝子組換え食品の安全性を評価する際には、アレルギーに関してどのようなことを調べているのですか。(平成21年3月) |
|
Ⅱ−A71. |
食品安全委員会では、遺伝子組換え食品の食品健康影響評価に当たり、主に、遺伝子組換えによって新たに付け加えられたり、除かれた全ての性質と、遺伝子組換えによって予期しない悪影響が生じる可能性がないかという点等について、これまでに食べられてきた食品と比較し、評価を行っています。
その内、アレルギー誘発性に関しては、まず次の4事項について調べ、挿入された遺伝子により作られるタンパク質の発現量も含めて総合的に判断した上で、安全性を確認しています。
(1)挿入する遺伝子を提供する微生物又は植物等についてアレルギー誘発性の報告があるか。
(2)挿入された遺伝子により作られるタンパク質がアレルゲンであるという報告があるか。
(3)挿入された遺伝子により作られるタンパク質が消化や加熱に対して安定であるかどうか。
(4)既に分かっているアレルゲンとなるタンパク質と挿入された遺伝子により作られるタンパク質の構造が似通っていないか。
なお、上記4項目でアレルゲンとなり得る可能性が否定できない場合は,
(5)挿入された遺伝子により作られるタンパク質とアレルギー患者血清中のIgE抗体との結合能の検討が行われ、さらに疑わしい場合、皮膚テスト、経口負荷試験等の臨床試験が求められることになります。
食品安全委員会の季刊誌「食品安全vol.5」でも『遺伝子組換え食品のリスク評価を理解する』という特集を組んでおりますので、ご覧ください。
( http://www.fsc.go.jp/sonota/5gou_2.pdf)
また、詳しくは、食品安全委員会ホームページに安全性評価基準を掲載しておりますのでご参考になさってください。
( http://www.fsc.go.jp/senmon/idensi/index.html)
(参考)IgE抗体:外部から侵入してきたアレルゲンに対し、人体は血清中にIgE抗体というタンパク質を作って反応します。IgE抗体はアレルゲンとの接触をくり返すうちに体内に蓄積し、一定量以上になると再びアレルゲンと接触したときに結びついて様々なアレルギー症状を引き起こします。
|
|
|
|
Ⅱ−Q74. |
遺伝子組換えパパイヤの安全性が食品安全委員会で評価されたと聞きました。パパイヤは生で食べることが多いですが、評価内容について教えてください。(平成21年12月) |
|
Ⅱ−A74. |
パパイヤは、パパイヤリングスポットウイルス(PRSV)に感染すると果実に斑点を生じ、糖度を下げるなど、収穫できなくなるほどの深刻な被害をもたらすことがあります。
遺伝子組換えパパイヤである「パパイヤリングスポットウイルス抵抗性パパイヤ55-1系統」(パパイヤ55−1)は、このPRSVの影響を受けないよう作製されました。パパイヤ55−1には、PRSVが持つリボ核酸をおおうタンパク質を作る遺伝子(PRSV
CP遺伝子)が導入されることにより、PRSVが増殖できなくなります。
パパイヤ55−1の食品としての安全性は、食品安全委員会が策定した「遺伝子組換え食品(種子植物)の安全性評価基準」に基づいて、導入されたPRSV
CP遺伝子等が作るタンパク質のアレルギー誘発性や、導入された遺伝子による意図しない影響の確認などが評価の中心となりました。
結果としては、
|
・ |
PRSVは多くのパパイヤに自然感染しており、被害の少ない果実は食用とされるが、健康被害の報告はなく、ヒトに対して病原性を示さないこと、 |
|
・ |
PRSV
CP遺伝子が作るタンパク質は、毒性やアレルギー誘発性を持つという報告はなく、生で食べても胃液で容易に分解されること、 |
|
・ |
仮に1日1個パパイヤを食べたとしても、PRSV
CP遺伝子が作るタンパク質の摂取量は日本人の平均的なタンパク質の摂取量に比べ、ごく微量であること、 |
|
・ |
パパイヤは元々、アレルギー物質などを持っているが、導入された遺伝子の影響で、その量が増えたり、新しい有害物質を作るおそれはないこと |
|
などから、パパイヤ55−1については、「ヒトの健康を損なうおそれはない」と判断しました。
この評価を受けて、パパイヤ55−1を日本で食品として許可するかどうかについては、リスク管理機関で検討されることとなります。
詳しくは、食品安全委員会ホームページに掲載されていますのでご覧下さい。
|
|
|
|
|
|
Ⅱ−Q77. |
特定保健用食品の許可に際して、食品安全委員会は安全性をどのように判断しているのでしょうか。(平成22年9月) |
|
Ⅱ−A77. |
特定保健用食品は、からだの生理学的機能などに影響を与える保健機能成分を含んでいて、特定の保健の用途に資する旨を表示して販売される食品です。特定保健用食品として販売するためには、製品ごとに有効性や安全性について審査を受け、表示について国の許可を受ける必要があります。
平成21年9月に消費者委員会と消費者庁が創設されたことに伴い、特定保健用食品の表示に関する業務が厚生労働省から消費者庁に移管され、消費者委員会の新開発食品調査部会などが有効性などを審議し、消費者庁長官が表示を許可することとなりました。この許可に先立ち、食品安全委員会は、消費者庁(消費者庁設立前は厚生労働省)からの依頼を受けて、科学的知見等に基づいた安全性の評価を行います。
この安全性の評価は、まず、食品安全委員会の下に設置した新開発食品専門調査会において個別の食品ごとに、構成成分、その食品または関与成分の食経験、食品形態を十分考慮した上で、消費者庁から提出された動物を用いた試験及びヒトにおける試験等のデータを基にして、原則として、当該食品中の関与成分について行います。評価に必要なデータなどが不足している場合には、追加のデータなどの提出を消費者庁に求めます。評価に当たっては、特定保健用食品は多くの場合疾病予備群の人を対象としていることや、病気を治療中の人が摂取する場合もあることなどを考慮しています。また、特に通常の食品とは異なる形態(錠剤、カプセル剤、エキス、粉末など)の場合には、過剰摂取される可能性なども考えつつ評価を行います。
同専門調査会の審議結果については、国民からの御意見・情報を30日間募集します。食品安全委員会では、国民から寄せられた御意見・情報も踏まえて、同専門調査会における審議結果を審議し、そこで得られた評価の結果を消費者庁に通知します。消費者庁は、この評価結果を踏まえて許可することになります。
|
|
|
|
|
|
|